тромб в левом желудочке сердца что делать
ПОАК или варфарин у пациентов с тромбом в левом желудочке?
Тромбоз в полости левого желудочка – редкое, но крайне опасное состояние, которое может возникнуть у пациентов после инфаркта миокарда или больных с дилатационной кардиомиопатией. Средством выбора в таких ситуациях является варфарин. В то же время его прием сопряжен с трудностями подбора дозы и необходимостью постоянного контроля международного нормализованного отношения. Обсуждается, что альтернативой варфарину могут быть прямые пероральные антикоагулянты (ПОАК). Однако их эффективность в данной клинической ситуации практически не изучена. В связи с чем целью обсуждающегося исследования стало сравнение эффективности варфарина и ПОАК в терапии пациентов с тромбом в левом желудочке.
В когортное исследование включались пациенты с подтвержденным при эхокардиографическом исследовании тромбом в левом желудочке в период с октября 2013 по март 2019 г.
Конечной точкой в исследовании был инсульт или системные эмболии.
В исследование было включено 514 пациентов; 379 из них были мужчинами, а средний возраст составил 58 лет.
Из них 300 пациентов получали варфарин и 185 – ПОАК. Медиана наблюдения составила 351 день.
Было установлено, что прием ПОАК сопровождался большим риском инсульта и системных эмболий в сравнении с варфарином (отношение рисков 2.71; 95% доверительный интервал 1.31-5.57; p=0.01). Причем такая зависимость сохранялась и в многофакторном анализе (отношение рисков 2.64; 95% довреительный интервал 1.28-5.43; p=0.01).
Таким образом, в представленном когортном исследовании прием ПОАК у пациентов с тромбом в левом желудочке сопровождался большим количеством инсультов и системных эмболий по сравнению с терапией варфарином. Вероятно, до проведелния специально спланированных проспективных исследований ПОАК не должны рассматриваться как альтернатива варфарину у пациентов с тромбом в левом желудочке.
Robinson A, et al. JAMA Cardiol. 2020. doi: 10.1001/jamacardio.2020.0652.
Всероссийская Образовательная Интернет-Сессия
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
Тромб в левом желудочке сердца что делать
Дилатационная кардиомиопатия (ДКМП) является самой распространенной (60% всех кардиомиопатий) и встречается во всех странах мира с частотой 5–8 случаев на 100000 населения. В частности, в США регистрируется 36 случаев на 100000 населения. Среди лиц негроидной расы и мужчин частота ДКМП в 2,5 раза выше, чем среди лиц европеоидной расы и женщин. Прогноз у пациентов с клиническими признаками сердечной недостаточности (СН) неблагоприятный. Уровень смертности составляет от 25% до 30% в год. После установления диагноза погибают 60–75% больных ДКМП в течение первых 5 лет [1]. Среди всех видов кардиомиопатий доля ДКМП составляет 50–60% [2].
ДКМП – наиболее часто встречающаяся форма кардиомиопатий с самым неблагоприятным прогнозом, характеризующаяся наличием дилатации, систолической дисфункции левого желудочка и истончением миокарда при отсутствии других заболеваний миокарда, расширением камер сердца, нарушением его сократительной функции и прогрессирующей хронической сердечной недостаточностью (ХСН). Для ДКМП характерно также развитие тромбоэмболий и внезапной смерти [3].
У больных с ХСН имеется склонность к гиперкоагуляции, стазу крови и повышенному тромбообразованию в полостях сердца, в том числе в левом желудочке (ЛЖ), поэтому они составляют группу высокого риска развития тромбоэмболических осложнений, в том числе заканчивающихся фатально [4, 5, 6]. У больных с ДКМП риск эмболических осложнений находится в пределах от 1% до 3,5% ежегодно и зависит от тяжести систолической дисфункции [7, 8].
Специфической этиопатогенетической терапии идиопатической ДКМП не существует. Основными целями терапии ДКМП являются замедление прогрессирования ХСН согласно Клиническим рекомендациям ОССН, РКО и РНМОТ по диагностике и лечению ХСН и улучшение прогноза [5].
Все чаще при неэффективности консервативной терапии ДКМП решается вопрос о трансплантации сердца, выживаемость при этом вмешательстве, по различным данным, составляет более 70% через 10 лет [9].
Есть данные о лечении стволовыми клетками (селективная клеточная терапия – трансплантация скелетно-мышечных или стволовых клеток). Однако в настоящее время вопрос подобной терапии исследован недостаточно и находится в фазе активных клинических испытаний. Прогноз при ДКМП остается условно неблагоприятным. Успехи в лечении привели к существенному увеличению выживаемости при этой форме КМП [10].
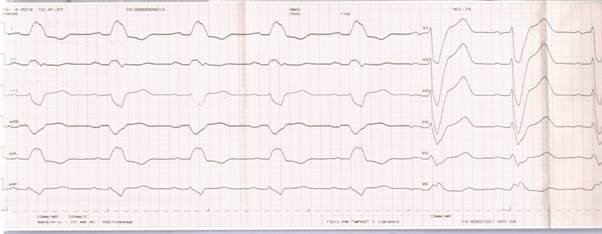
Клинический пример. Больной С., 41 года поступил в кардиологическое отделение ГБУЗ РМ «МРЦКБ» г. Саранска с жалобами на одышку при незначительной физической нагрузке, чувство нехватки воздуха в горизонтальном положении, сопровождающееся сухим кашлем, отеки нижних конечностей, общую слабость. АД повышается около 7 лет, макс. САД 180 мм рт. ст., адаптирован к АД 140 и 90 мм рт. ст. Полная блокада левой ножки пучка Гиса (ПБЛНПГ) на ЭКГ регистрируется около 6 лет. По поводу сердечно-сосудистых заболеваний в условиях стационара не обследовался и не лечился. В 2013 г. обследовался в нефрологическом отделении ГБУЗ РМ «МРЦКБ», диагностирован хронический гломерулонефрит, смешанный вариант, активность III степени, проводилась иммуносупрессивная терапия циклофосфаном и метипредом. Рекомендациям по контролю анализов не следовал, лекарственной терапии не придерживался. Амбулаторно нерегулярно принимает моноприл и андипал при повышении АД. Инфаркт миокарда, сахарный диабет в анамнезе отрицает. За 2–3 недели до госпитализации появились прогрессирующая одышка, повышенная утомляемость, сухой кашель. В поликлинике по месту жительства врачом-терапевтом указанные клинические симптомы были расценены как проявление респираторной инфекции. Назначенная терапия (антибиотики, муколитики, народные средства) привела к улучшению симптомов: температура тела нормализовалась, кашель несколько уменьшился, а потом возобновился, одышка и тахикардия сохранялись, стали нарастать отеки на нижних конечностях. После проведенных обследований (результаты представлены ниже) 04.04.2019 г. госпитализирован в кардиологическое отделение № 1 ГБУЗ РМ МРЦКБ. Анамнез жизни: материально-бытовые условия удовлетворительные. Не курит. Родители живы, по поводу заболеваний ССС амбулаторно не наблюдаются. Двое детей – здоровы. Перенесенные заболевания: простудные, ангина, аппендэктомия в 1997 г., хронический гломерулонефрит с 2013 г. Трансфузионный анамнез: Кровь (ее компоненты) и кровезаменители не переливали (со слов пациента). Аллергологический анамнез: не отягощен. Объективно при госпитализации в стационар: Общее состояние средней степени тяжести. Сознание ясное. Адекватен. Питание повышенное. ИМТ – 31,1 кг/м². Положение – склонность к ортопноэ. Кожные покровы цвета загара с сероватым оттенком, сухие. При исследовании периферических лимфатических узлов их увеличения не выявлено. Наблюдались отеки голеней и стоп. Щитовидная железа не пальпируется. Костно-мышечный аппарат без видимой патологии. Дыхательная система. Грудная клетка обычной формы. При перкуссии легких – перкуторный звук легочный, притуплен в нижних отделах, больше справа. При аускультации легких выявлены жесткое дыхание, ослабленное в нижних отделах с обеих сторон, единичные мелкопузырчатые хрипы в нижних боковых отделах с обеих сторон, ЧДД – 20 в минуту. SpO2 = 97%. Сердечно-сосудистая система. Область сердца не изменена. Верхушечный толчок в V межреберье. Границы относительной сердечной тупости: правая на 1,0 см кнаружи от правого края грудины в IV м/р, верхняя в III м/р слева от грудины, левая на 1,5 см кнаружи от левой срединно-ключичной линии V м/р. Аускультативно – тоны сердца приглушены, ритм сердца правильный, ЧСС – 110 уд. в минуту; АД – 140/100 мм рт. ст. Система органов пищеварения. Слизистые оболочки ротовой полости чистые, влажные. Язык обложен у корня белым налетом. Живот при пальпации мягкий, безболезненный. Печень выступает из-под края правой реберной дуги на 5 см. Селезенка не пальпируется. Почки и мочевыводящие пути. При осмотре поясничная область не изменена. Пальпаторно почки не прощупываются. Симптом Пастернацкого отрицательный с обеих сторон. Результаты догоспитальных исследований: ЭКГ от 04.04.2019 г.: синусовая тахикардия с ЧСС – 110 уд/мин. Горизонтальное положение ЭОС. Регистрируется полная БЛНПГ (рис. 1).
Рис. 1. ЭКГ больного С., 41 год
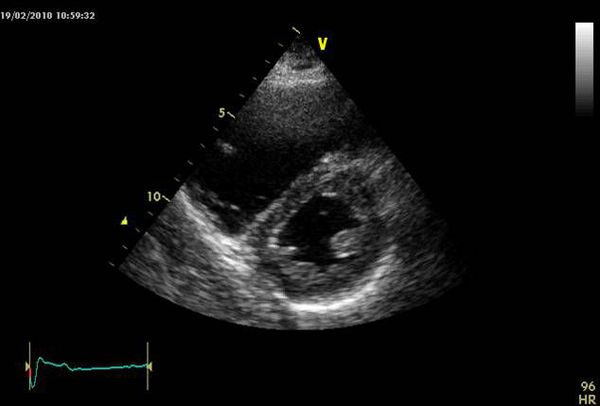
Общий анализ крови от 04.04.2019 г.: НВ – 159 г/л, лейкоциты 9,8х10*9/л. ЭХО-КС от 04.04.2019 г. (ЦРБ): Заключение: Кардиомегалия (дилатация всех камер сердца). Снижение глобальной сократимости миокарда ЛЖ (УО – 74 мл, ФВ – 29%). Нарушение сократимости ЛЖ (передне-перегородочно-боковых стенок в апикальном отделе, средних отделов). Тромб верхушки ЛЖ 47×21 мм, фиксирован основанием к стенке ЛЖ. Митральная регургитация (МР) 2-й степени. Выраженная легочная гипертензия, СДЛА – 68,4 мм рт. ст. Гидроперикард. В обеих плевральных полостях свободная жидкость: слева – незначительное количество, справа – до X ребра. УЗИ органов брюшной полости и почек от 04.04.2019 г. (ЦРБ): Заключение: Гепатомегалия. Диффузные изменения паренхимы печени. Неспецифические изменения синусов почек. В динамике патологических изменений показателей анализа крови не выявлено. Биохимический анализ крови от 05.04.2019 г.: Сахар крови в пределах нормы (4,0 ммоль/л), протеинограмма без изменений (общий белок – 74 г/л, альбумины – 56%, α1-глобулины – 4%, α2-глобулины – 11%, β-глобулины – 12%, γ-глобулины – 17%), Cа2+ – 1,97 ммоль/л, фосфор – 1,35 ммоль/л, СРБ (-), АЧТВ – 36,1 сек, ПТИ – 102%, ТВ – 13,4 сек, фибриноген – 4,79 г/л, антитромбин III – 105%. МНО от 11.09.2019 г.: 0,99 условных единиц. Биохимический анализ крови от 08.04.2019 г.: общий белок – 68 г/л, альбумины – 56%, α1-глобулины – 4%, α2-глобулины – 11%, β-глобулины – 12%, γ-глобулины – 17%, альбумин – 42 г/л, мочевина – 10,6 ммоль/л, креатинин – 199 мкмоль/л, общий холестерин – 4,88 ммоль/л, триглицериды – 1,26 ммоль/л, ЛПНП – 3,15 ммоль/л, ЛПВП – 1,08 ммоль/л. К+ – 4,0 ммоль/л, Na+ –139 ммоль/л, Cа2+ – 2,3 ммоль/л, магний – 0,82 ммоль/л, АСТ – 28 Е/л, АЛТ – 32 Е/л, АЧТВ – 33,6 сек. Биохимический анализ крови от 15.04.2019 г.: мочевина – 7,5 ммоль/л, креатинин – 167 мкмоль/л. МНО 1,1 условной единицы. МНО 1,29 условной единицы (18.04.2019 г.). МНО 1,44 условной единицы (19.04.2019 г.). В общем анализе мочи наблюдался мочевой синдром: удельный вес – 1010, белок 0,48 мг/л, эпителий плоский – 0–1 в поле зрения, эритроциты измененные – 8–10 в поле зрения, лейкоциты – 0–1 в поле зрения, цилиндры гиалиновые – 0–1 в поле зрения, ураты. Суточная потеря белка от 06.04.2019 г.: 0,3 г/сут. Скорость клубочковой фильтрации от 05.04.2019 г.: Креатинин крови – 199 мкмоль/л, возраст – 41 год. СКФ по формуле CKD-EPI = 35 мл/мин/1,73 м2. Скрининг на аутоиммунные системные заболевания: антитела к нативной ДНК – отрицательно; антитела к денатурированной ДНК – отрицательно; антитела к нуклеосомам кл. Z – 1 Е/мл; ИФА крови на волчаночные АТ – 0,25 Е/мл. Рентгенограмма органов грудной клетки выявила кардиомегалию (увеличение кардиоторакального индекса, смещение границ сердца влево, выбухание дуги правого предсердия), картину застойных изменений в МКК. Проведено определение генетических полиморфизмов генов, влияющих на подбор дозы варфарина (табл. 1). Генетических изменений, влияющих на подбор дозы варфарина, выявлено не было. Целевое значение МНО (2–3 условные единицы) было достигнуто через 3 недели от начала приема варфарина, доза которого составила 11,25 мг, МНО от 27.04.2019 г.: 2,4 условной единицы.
Результаты определения генетических полиморфизмов генов,
Тромбоз левого предсердия у пациентов с фибрилляцией на фоне антикоагулянтной терапии
Мета-анализ показал необходимость проведения на предоперационном этапе ЧПЭхоКГ для выявления тромбоза левого предсердия среди пациентов с фибрилляцией и трепетанием предсердий на фоне антикоагулянтной терапии
Фибрилляция (ФП) и трепетание (ТП) предсердий – наиболее распространенные нарушения сердечного ритма, которые могут приводить к формированию тромбов в области левого предсердия (ЛП). Тромбоз ЛП (ТЛП) и, в частности, ушка ЛП, опасен такими грозными осложнениями, как ишемический инсульт и тромбоэмболия легочной артерии.
Восстановление ритма в случаях ФП и ТП при помощи кардиоверсии или катетерной абляции требует проведения антикоагулянтной терапии на протяжении не менее 3 недель до хирургического вмешательства для предотвращения периоперационных тромбоэмболических осложнений. Однако антикоагулянтная терапия не всегда гарантирует отсутствие ТЛП на дооперационном этапе, и для исключения тромбоза требуется проведение уточняющей чреспищеводной Эхо-КГ (ЧПЭхоКГ). Значимость ЧПЭхоКГ подтверждает опубликованная в Journal of the American College of Cardiology статья, авторы которой решили оценить распространенность случаев ТЛП и выявить группы риска по тромбообразованию на фоне антикоагулянтной терапии среди пациентов с ФП и ТП.
В мета-анализ было включено 35 обсервационных исследований с общей выборкой из 14 653 пациентов с ФП или ТП, которым проводилась ЧПЭхоКГ для исключения ТЛП после курса предоперационной антикоагулянтной терапии. Длительность приема пероральных антикоагулянтов (варфарин или прямые оральные антикоагулянты (ПОАК)) в каждом случае составляла не менее 3 недель. При обнаружении ТЛП хирургическое вмешательство откладывалось до полного разрешения тромбов.
Согласно полученным данным, несмотря на проведение антикоагулянтной терапии, распространенность ТЛП среди изучаемой когорты пациентов составила в среднем 2,73% (95% ДИ, от 1.95% до 3.80%). Также в ходе анализа были определены группы пациентов высокого риска по развитию ТЛП на фоне антикоагулянтной терапии:
1) Пациенты с непароксизмальной формой ФП или ТП (4,81% против 1,03% у пациентов с пароксизмальной болезнью (p
Внутрисердечные тромбы
Для жителей районов Савеловский, Беговой, Аэропорт, Хорошевский
В этом месяце жителям районов Савеловский, Беговой, Аэропорт, Хорошевский» предоставляется скидка 5% на ВСЕ мед.
Скидки для друзей из социальных сетей!
Захаров Станислав Юрьевич
Врач-кардиолог, врач функциональной диагностики
Высшая квалификационная категория, доктор медицины, Член Европейского общества кардиологов и Российского кардиологического общества
Рудько Гали Николаевна
Врач-кардиолог, врач функциональной диагностики
Высшая квалификационная категория, Член Российского кардиологического общества
«Men’s Health», медицинский блог (июль 2014г.)
«Доброе утро», ТВ-программа, Первый канал (июнь 2014г.)
Тромбы могут образовываться не только в венах, но и в полостях сердца, артериях.
Образование тромбов – естественная реакция организма. Они способствуют восстановлению поврежденных сосудов. Тромб – это сгусток крови, содержащий фибрин (белок, необходимый для свертывания крови). А вот тромбы в полостях сердца – совсем другое дело.
Самое опасное – нет никаких симптомов, по которым можно заподозрить наличие внутрисердечных тромбов. Обнаружить тромб в полостях сердца можно только при диагностике (эхокардиографии и др.). А какие-либо симптомы (одышку или удушье) человек может ощущать разве что при тромбоэмболии легочной артерии.
Тромбы могут быть в левых или в правых полостях сердца, находиться в предсердиях либо желудочках (чаще это пристеночные тромбы).
Какими бывают тромбы:
Тромбы в левых отделах сердца
Чаще всего тромбы в левых полостях сердца встречаются на фоне трех заболеваний.
В зоне риска находятся люди:
Тромбы в левых отделах сердца – риск возникновения артериальных тромбоэмболий, ишемических атак или инфарктов мозга! При локализации тромбов в левых полостях сердца также могут поражаться артерии почек, верхних и нижних конечностей, артерии кишечника.
Инфаркты и инсульты
При наличии открытого овального окна в межсердечной перегородке тромбы из вен нижних конечностей, таза могут переместиться из правого предсердия в левое и далее с током крови попасть в мозг. В результате также наступает инсульт.
Тромбы, образующиеся при аневризме сердца
После перенесенного инфаркта в левом желудочке могут образоваться пристеночные тромбы. Их видят специалисты с помощью эхокардиографии. Это основной вид диагностики для обнаружения тромбов в полостях сердца. В случае их обнаружения специалист может назначить антикоагулянты (при отсутствии противопоказаний).
Тромбы, образующиеся при стенозе митрального клапана
Бывает особая разновидность — шаровидный тромб в левом предсердии. Такой тромб образуется при стенозе митрального клапана, при котором нарушается отток из левого предсердия в левый желудочек.
Тромбы, образующиеся при мерцательной аритмии (фибрилляции предсердий)
При мерцательной аритмии тромбы обычно локализуются в ушках левых предсердий. Ушко представляет собой выпячивание предсердия (оно похоже на мешочек). Тромбы ушка левого предсердия можно выявить чаще всего только при чреспищеводной Эхо-КГ. С помощью эхокардиографии их обнаружить очень трудно.
Тромбы в правых отделах сердца
Наличие тромба в правых отделах сердца чревато осложнениями в виде тромбоэмболии ветвей легочной артерии (заболевание, при котором поражаются артерии легких). ТЭЛА – одно из самых опасных осложнений.
Тромб может сначала образоваться в глубоких венах нижних конечностей. Если флотирующий тромб отрывается, то с током крови попадает сначала в правые отделы сердца, а потом в легочную артерию. Это может привести к внезапной смерти!
Диагностика
Основной способ диагностики внутрисердечных тромбов в «МедикСити» – эхокардиография.
Если нужно диагностировать тромбы в венах, проводится дуплексное сканирование вен нижних конечностей и др.
Лечение
Для предупреждения тромбообразования специалист может назначить вам антикоагулянты или антиагреганты (при отсутствии противопоказаний).
Пациентам со стенозом митрального клапана, мерцательной аритмией или постинфарктной аневризмой необходим регулярный эхокардиографический контроль! Особенно при наличии протезированных клапанов. В этом случае ЭХО-КГ нужно делать каждый год.
После инфаркта миокарда нужно проверять, не образовался ли тромб в полости сердца.
В зоне риска также находятся те, кто принимает гормональную контрацепцию. Они повышают риск возникновения тромбоза, а также инфаркта миокарда. Вы можете найти предупреждение в инструкции среди побочных эффектов.
Внутрисердечные тромбы могут привести к серьезным осложнениям! В случае необходимости обращайтесь к врачу и соблюдайте все рекомендации.
Захаров Станислав Юрьевич
Врач-кардиолог, врач функциональной диагностики
Высшая квалификационная категория, доктор медицины, Член Европейского общества кардиологов и Российского кардиологического общества
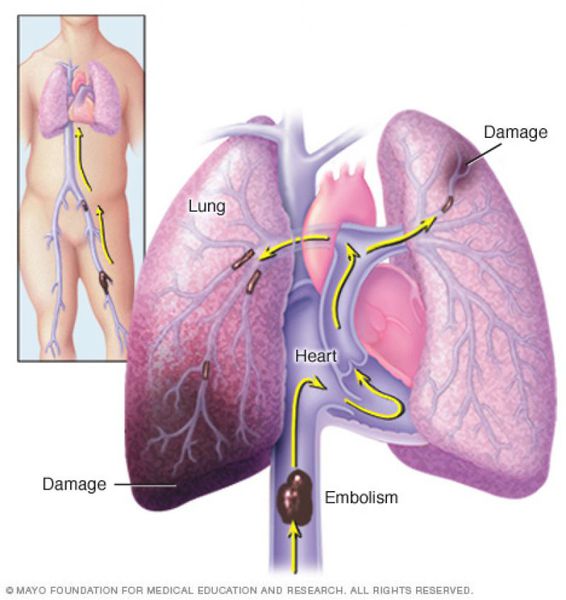
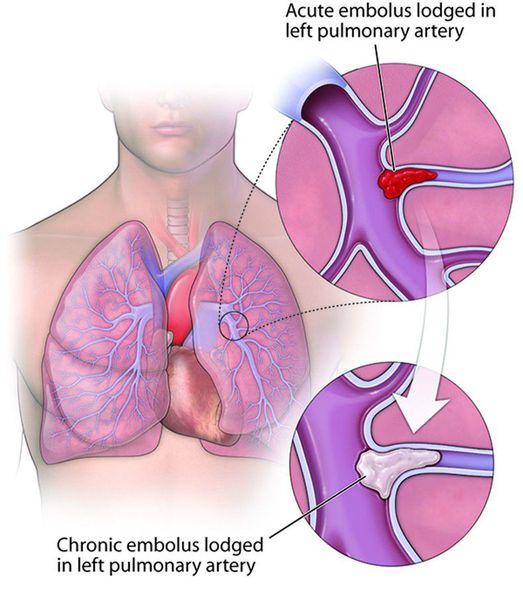
Что такое тромбоэмболия легочной артерии (ТЭЛА)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Гринберг М. В., кардиолога со стажем в 32 года.
Определение болезни. Причины заболевания
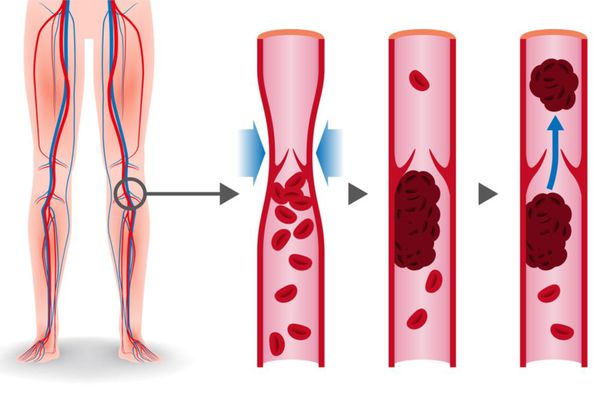
Тромбоэмболия лёгочной артерии (ТЭЛА) — это закупорка лёгочных артерий тромбами различной природы, чаще всего образующихся в крупных венах нижних конечностей или малого таза.
Факторами риска тромбоэмболии лёгочной артерии являются патологические состояния, при которых имеется нарушенный возврат венозной крови, повреждение эндотелия или эндотелиальная дисфункция и гиперкоагуляционные нарушения.
В результате тромбоэмболии лёгочных артерий прекращается кровоснабжение лёгочной ткани, развивается некроз (отмирание тканей), возникает инфаркт-пневмония, дыхательная недостаточность. Увеличивается нагрузка на правые отделы сердца, развивается правожелудочковая недостаточность кровообращения: цианоз (посинение кожи), отёки на нижних конечностях, асцит (скопление жидкости в брюшной полости). Заболевание может развиваться остро или постепенно, в течение нескольких часов или дней. В тяжёлых случаях развитие ТЭЛА происходит стремительно и может привести к резкому ухудшению состояния и гибели больного.
Каждый год от ТЭЛА умирает 0,1% населения земного шара. По частоте смертельных исходов заболевание уступает только ИБС (ишемической болезни сердца) и инсульту. Больных ТЭЛА умирает больше, чем больных СПИДом, раком молочной, предстательной желез и пострадавших в дорожно-траспортных проишествиях вместе взятых. Большинству больным (90%), умершим от ТЭЛА, вовремя не был установлен правильный диагноз, и не было проведено необходимое лечение. ТЭЛА часто возникает там, где её не ожидают — у больных некардиологическими заболеваниями (травмы, роды), осложняя их течение. Смертность при ТЭЛА достигает 30%. При своевременном оптимальном лечении смертность может быть снижена до 2-8%. [2]
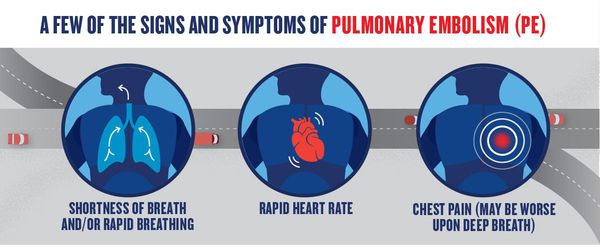
Симптомы ТЭЛА зависят от величины тромбов, внезапности или постепенного появления симптомов, длительности заболевания. Течение может быть очень разным — от бессимптомного до быстро прогрессирующего, вплоть до внезапной смерти.
ТЭЛА — болезнь-призрак, которая носит маски других заболеваний сердца или лёгких. Клиника может быть инфарктоподобная, напоминать бронхиальную астму, острую пневмонию. Иногда первым проявлением болезни является правожелудочковая недостаточность кровообращения. Главное отличие — внезапное начало при отсутствии других видимых причин нарастания одышки.
Этиология
ТЭЛА развивается, как правило, в результате тромбоза глубоких вен, который развивается обычно за 3-5 дней до начала заболевания, особенно при отсутствии антикоагулянтной терапии.
Факторы риска тромбоэмболии лёгочной артерии
При диагностике учитывают наличие факторов риска тромбоэмболии. Наиболее значимые из них: перелом шейки бедра или конечности, протезирование бедренного или коленного сустава, большая операция, травма или поражение мозга.
К опасным (но не столь сильно) факторам относят: артроскопию коленного сустава, центральный венозный катетер, химиотерапию, хроническую сердечную недостаточность, гормонзаместительную терапию, злокачественные опухоли, пероральные контрацептивы, инсульт, беременность, роды, послеродовой период, тромбофилию. При злокачественных новообразованиях частота венозной тромбоэмболии составляет 15% и является второй по значимости причиной смерти этой группы больных. Химиотерапевтическое лечение увеличивает риск венозной тромбоэмболии на 47%. Ничем не спровоцированная венозная тромбоэмболия может быть ранним проявлением злокачественного новообразования, которое диагностируется в течение года у 10% пациентов эпизода ТЭЛА. [2]
К наиболее безопасным, но всё же имеющим риск, факторам относят все состояния, сопряжённые с длительной иммобилизацией (неподвижностью) — длительный (более трёх суток) постельный режим, авиаперелёты, пожилой возраст, варикозное расширение вен, лапароскопические вмешательства. [3]
Некоторые факторы риска — общие с тромбозами артериального русла. Это те же факторы риска осложнений атеросклероза и гипертонической болезни: курение, ожирение, малоподвижный образ жизни, а также сахарный диабет, гиперхолестеринемия, психологический стресс, низкий уровень употребления овощей, фруктов, рыбы, низкий уровень физической активности.
Чем больше возраст больного, тем более вероятно развитие заболевания.
Наконец, сегодня доказано существование генетической предрасположенности к ТЭЛА. Гетерозиготная форма полиморфизма V фактора увеличивает риск исходных венозных тромбоэмболий в три раза, а гомозиготная форма — в 15-20 раз.
К наиболее значимым факторам риска, способствующим развитию агрессивной тромбофилии, относятся антифосфолипидный синдром с повышением антикардиолипиновых антител и дефицит естественных антикоагулянтов: протеина С, протеина S и антитромбина III.
Симптомы тромбоэмболии легочной артерии
Симптомы заболевания разнообразны. Не существует ни одного симптома, при наличии которого можно было точно сказать, поставить диагноз ТЭЛА.
К признакам ТЭЛА относятся загрудинные инфарктоподобные боли, одышка, кашель, кровохарканье, артериальная гипотония, цианоз, синкопальные состояния (обмороки), что также может встречаться и при других различных заболеваниях.
Часто диагноз ставится после исключения острого инфаркта миокарда. Характерной особенностью одышки при ТЭЛА является возникновение её без связи с внешними причинами. Например, больной отмечает, что не может подняться на второй этаж, хотя накануне делал это без усилий. При поражении мелких ветвей лёгочной артерии симптоматика в самом начале может быть стёртой, неспецифичной. Лишь на 3-5 день появляются признаки инфаркта лёгкого: боли в грудной клетке; кашель; кровохарканье; появление плеврального выпота (скопление жидкости во внутренней полости тела). Лихорадочный синдром наблюдается в период от 2 до 12 дней.
Полный комплекс симптомов встречается лишь у каждого седьмого больного, однако 1-2 признака встречаются у всех пациентов. При поражении мелких ветвей лёгочной артерии диагноз, как правило, выставляется лишь на этапе образования инфаркта лёгкого, то есть через 3-5 суток. Иногда больные с хронической ТЭЛА длительное время наблюдаются у пульмонолога, в то время как своевременная диагностика и лечение позволяют уменьшить одышку, улучшить качество жизни и прогноз.
Поэтому с целью минимизации затрат на диагностику разработаны шкалы для определения вероятности заболевания. Эти шкалы считаются практически равноценными, но Женевская модель оказалась более приемлемой для амбулаторных пациентов, а шкала P.S.Wells — для стационарных. Они очень просты в использовании, включают в себя как основные причины (тромбоз глубоких вен, новообразования в анамнезе), так и клинические симптомы.
Параллельно с диагностикой ТЭЛА врач должен определить источник тромбоза, и это довольно трудная задача, так как образование тромбов в венах нижних конечностей часто протекает бессимптомно.
Патогенез тромбоэмболии легочной артерии
В основе патогенеза лежит механизм венозного тромбоза. Тромбы в венах образуются вследствие снижения скорости венозного кровотока из-за выключения пассивного сокращения венозной стенки при отсутствии мышечных сокращений, варикозном расширении вен, сдавлении их объёмными образованиями. На сегодняшний день врачи не могут поставить диагноз расширение вен малого таза (у 40% больных). Венозный тромбоз может развиваться при:
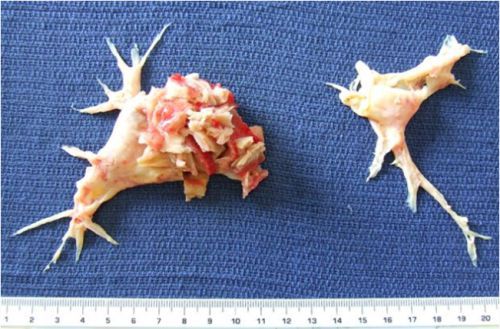
Тромбы могут быть обнаружены с помощью ультразвука. Опасными являются те, которые прикреплены к стенке сосуда и двигаются в просвете. Они могут оторваться и с током крови переместиться в лёгочную артерию. [1]
Гемодинамические последствия тромбоза проявляются при поражении свыше 30-50% объёма лёгочного русла. Эмболизация сосудов лёгких приводит к повышению сопротивления в сосудах малого круга кровообращения, повышению нагрузки на правый желудочек, формированию острой правожелудочковой недостаточности. Однако тяжесть поражения сосудистого русла определяется не только и не столько объёмом тромбоза артерий, сколько гиперактивацией нейрогуморальных систем, повышенным выбросом серотонина, тромбоксана, гистамина, что приводит к вазоконстрикции (сужению просвета кровеносных сосудов) и резкому повышению давления в лёгочной артерии. Страдает перенос кислорода, появляется гиперкапния (увеличивается уровень содержания углекислого газа в крови). Правый желудочек дилятируется (расширяется), возникает трикуспидальная недостаточность, нарушение коронарного кровотока. Снижается сердечный выброс, что приводит к уменьшению наполнения левого желудочка с развитием его диастолической дисфункции. Развивающаяся при этом системная гипотензия (снижение артериального давления) может сопровождаться обмороком, коллапсом, кардиогенным шоком, вплоть до клинической смерти.
Возможная временная стабилизация артериального давления создает иллюзию гемодинамической стабильности пациента. Однако через 24-48 часов развивается вторая волна падения артериального давления, причиной которой являются повторные тромбоэмболии, продолжающийся тромбоз вследствие недостаточной антикоагулянтной терапии. Системная гипоксия и недостаточность коронарной перфузии (прохождения крови) обусловливают возникновение порочного круга, приводящего к прогрессированию правожелудочковой недостаточности кровообращения.
Эмболы небольшого размера не ухудшают общего состояния, могут проявляться кровохарканьем, ограниченными инфаркт-пневмониями. [5]
Классификация и стадии развития тромбоэмболии легочной артерии
Существует несколько классификаций ТЭЛА: по остроте процесса, по объёму поражённого русла и по скорости развития, но все они сложны при клиническом применении.
По объёму поражённого сосудистого русла различают следующие виды ТЭЛА:
Клиническое течение ТЭЛА бывает острейшим («молниеносным»), острым, подострым (затяжным) и хроническим рецидивирующим. Как правило, скорость течения заболевания связана с объёмом тромбирования ветвей лёгочных артерий.
По степени тяжести выделяют тяжёлую (регистрируется у 16-35%), среднетяжёлую (у 45-57%) и лёгкую форму (у 15-27%) развития заболевания.
Большее значение для определения прогноза больных с ТЭЛА имеет стратификация риска по современным шкалам (PESI, sPESI), включающий 11 клинических показателей. На основании этого индекса пациент относится к одному из пяти классов (I-V), в которых 30-дневная летальность варьирует от 1 до 25%.
Осложнения тромбоэмболии легочной артерии
Острая ТЭЛА может служить причиной остановки сердца и внезапной смерти. При постепенном развитии возникает хроническая тромбоэмболическая лёгочная гипертензия, прогрессирующая правожелудочковая недостаточность кровообращения.
Хроническая тромбоэмболическая лёгочная гипертензия (ХТЭЛГ) — форма заболевания, при которой происходит тромботическая обструкция мелких и средних ветвей лёгочной артерии, вследствие чего повышается давление в лёгочной артерии и увеличивается нагрузка на правые отделы сердца (предсердие и желудочек).
ХТЭЛГ — уникальная форма заболевания, потому что может быть потенциально излечима хирургическими и терапевтическими методами. Диагноз устанавливается на основании данных катетеризации лёгочной артерии: повышения давления в лёгочной артерии выше 25 мм рт. ст., повышения лёгочного сосудистого сопротивления выше 2 ЕД Вуда, выявления эмболов в лёгочных артериях на фоне продолжительной антикоагулянтной терапии более 3-5 месяцев.
Тяжёлым осложнением ХТЭЛГ является прогрессирующая правожелудочковая недостаточность кровообращения. Характерным является слабость, сердцебиение, снижение переносимости нагрузок, появление отёков на нижних конечностях, накопление жидкости в брюшной полости (асцит), грудной клетке (гидроторакс), сердечной сумке (гидроперикард). При этом одышка в горизонтальном положении отсутствует, застоя крови в лёгких нет. Часто именно с такими симптомами пациент впервые попадает к кардиологу. Данные о других причинах болезни отсутствуют. Длительная декомпенсация кровообращения вызывает дистрофию внутренних органов, белковое голодание, снижение массы тела. Прогноз чаще всего неблагоприятный, возможна временная стабилизация состояния на фоне медикаментозной терапии, но резервы сердца быстро исчерпываются, отёки прогрессируют, продолжительность жизни редко превышает 2 года.
Диагностика тромбоэмболии легочной артерии
Методы диагностики ТЭЛА, применяемые к конкретным больным, зависят прежде всего от определения вероятности заболевания, тяжести состояния пациента и возможностей лечебных учреждений.
Для диагностики ТЭЛА используется следующий алгоритм:
Оценка клинической вероятности
При оценке вероятности ТЭЛА учитывают следующие факторы: операция или перелом в предшествующий месяц, злокачественная опухоль, возраст старше 65 лет, кровохарканье, боль в нижней конечности с одной стороны, высокая частота сердечных сокращений.
Анализы для диагностики ТЭЛА
Метод определения D-димера доказал свою высокую значимость при подозрении на ТЭЛА. Однако тест не является абсолютно специфичным, так как повышенные результаты встречаются и при отсутствии тромбоза, например, у беременных, пожилых людей, при фибрилляции предсердий, злокачественных новообразованиях. Поэтому пациентам с высокой вероятностью заболевания это исследование не показано. Однако при низкой вероятности тест достаточно информативен для исключения тромбообразования в сосудистом русле.
В случаях подозрения и при доказанности ТЭЛА дополнительными лабораторными исследованиями являются сердечные маркеры:
Компьютерная томография
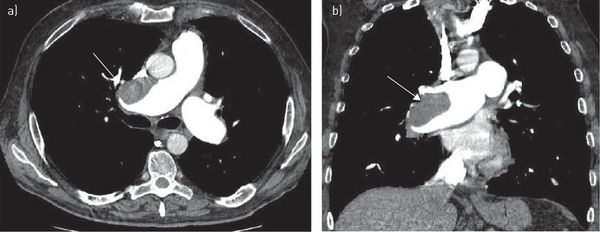
Компьютерная томография грудной клетки с контрастированием сосудов — высокодоказательный метод диагностики тромбоэмболии лёгочной артерии. Позволяет визуализировать как крупные, так и мелкие ветви лёгочной артерии.
При невозможности выполнения КТ грудной клетки (беременность, непереносимость йодсодержащих контрастных веществ и т.д.) возможно выполнение планарной вентиляционно-перфузионной (V/Q) сцинтиграфии лёгких. Этот метод может быть рекомендован многим категориям больных, однако на сегодняшний день он остаётся малодоступным.
Зондирование правых отделов сердца и ангиопульмонография является наиболее информативным в настоящее время методом. С его помощью можно точно определить как факт эмболии, так и объём поражения. [6]
К сожалению, не все клиники оснащены изотопными и ангиографическими лабораториями. Но выполнение скрининговых методик при первичном обращении пациента — ЭКГ, обзорная рентгенография грудной клетки, УЗИ сердца, УЗДГ вен нижних конечностей — позволяет направить больного на МСКТ (многосрезовую спиральную компьютерную томографию) и дальнейшее обследование.
ЭКГ при ТЭЛА
На первом месте по своей диагностической значимости среди инструментальных методов обследования находится электрокардиография, которая должна выполняться всем пациентам. Патологические изменения на ЭКГ — остро возникшая перегрузка правого предсердия и желудочка, сложные нарушения ритма, признаки недостаточности коронарного кровотока — позволяют заподозрить заболевание и выбрать правильную тактику, определяя тяжесть прогноза.
Оценка размеров и функции правого желудочка, степени трикуспидальной недостаточности по ЭХОКГ позволяет получить важную информацию о состоянии кровотока, давлении в лёгочной артерии, исключает другие причины тяжёлого состояния пациента, такие как тампонада перикарда, диссекцию (рассечение) аорты и другие. Однако это не всегда выполнимо в связи с узким ультразвуковым окном, ожирением пациента, невозможностью организовать круглосуточную службу УЗИ, часто с отсутствием чрезпищеводного датчика.
УЗИ при ТЭЛА
Для определения тромбоза глубоких вен высокую чувствительность и специфичность имеет УЗИ вен нижних конечностей, которое для скрининга может проводиться в четырёх точках: паховых и подколенных областях с обеих сторон. Увеличение зоны исследования повышает диагностическую ценность метода.
Лечение тромбоэмболии легочной артерии
Основная цель лечения при тромбоэмболии лёгочной артерии — сохранение жизни больного и профилактика формирования хронической лёгочной гипертензии. В первую очередь для этого необходимо остановить процесс тромбообразования в лёгочной артерии, который, как уже говорилось выше, происходит не одномоментно, а в течение нескольких часов или дней.
Методы лечения ТЭЛА в острую фазу:
Подбор схем приёма препаратов при системном тромболизисе проводит врач, они могут отличаться в зависимости от состояния пациента.
Хирургические процедуры
Для лечения ТЭЛА высокого риска при массивном тромбозе показано восстановление проходимости закупоренных артерий — хирургическая тромбэктомия, так как это приводит к нормализации гемодинамики.
Для определения стратегии лечения и риска смерти в настоящее время предпочтительными шкалами в ранний период ТЭЛА являются шкалы PESI и sPESI, но только при лечении ТЭЛА низкого риска и у пациентов со стабильной гемодинамикой.