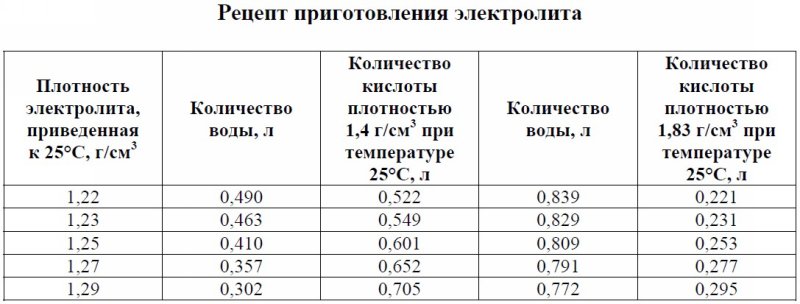
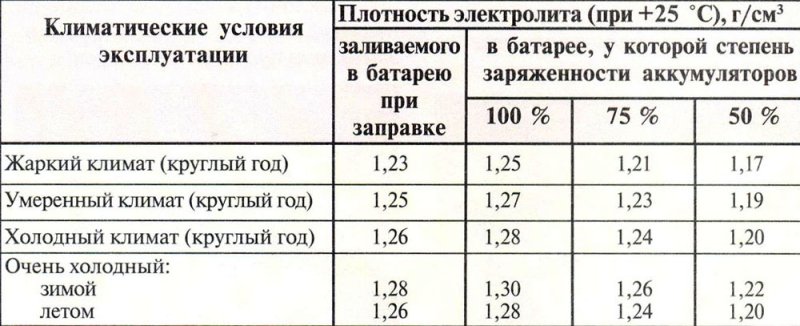
Как сделать азотную кислоту из электролита в домашних условиях
Как сделать азотную кислоту из электролита в домашних условиях
Получение азотной кислоты в домашних условиях: как обращаться с реагентами
Получение азотной кислоты в домашних условиях: как обращаться с реагентами
Химия — увлекательная наука. Те, кто интересуются не только теорией, но и пробует свои навыки на практике, точно знают, о чем идет речь. С большинством элементов из таблицы Менделеева знаком каждый школьник. Но всем ли удалось попробовать на собственном опыте смешивать реагенты и проводить химические испытания? Даже сегодня не во всех современных школах имеется в наличии необходимое оборудование и реагенты, потому химия остается наукой открытой для самостоятельного изучения. Многие стремятся познать ее глубже, проводя исследования в домашних условиях.
Ни один самодельщик не обойдется без азотной кислоты — крайне важной в хозяйстве вещи. Достать вещество сложно: приобрести его можно только в специализированном магазине, где покупка осуществляется по подтверждающим мирное использование вещества документам. Потому если вы мастер-самоделка, достать этот компонент, скорее всего, не получится. Здесь и возникает вопрос о том, как сделать азотную кислоту в домашних условиях. Процесс вроде не отличается сложностью, тем не менее на выходе должно получиться вещество достаточного уровня чистоты и необходимой концентрации. Здесь без навыков химика-экспериментатора никак не обойтись.
Химические свойства азотной кислоты
HNO3 является одной из самых сильных кислот — в водных растворах полностью диссоциирует на катионы водорода и нитрат-ионы:
HNO3 ↔ H + +NO3 —
Азотная кислота вступает в реакции:
Следует обратить внимание, что азотная кислота в обменных реакциях может взаимодействовать далеко не со всеми солями, а лишь только с теми, при реагировании с которыми образуются нерастворимые, слабодиссоциирующие и газообразные вещества, которые, по мере их образования, более не участвуют в реакции обмена. В обменных реакциях солями, при взаимодействии с которыми образуются растворимые в воде соли азотной кислоты, азотная кислота не участвует.
По этой причине образование тех или иных продуктов реакции азотной кислоты и металла зависит от концентрации кислоты и активности металла.
Атом азота в молекуле азотной кислоты имеет степень окисления +5, и может принимать 1, 2, 3, 4, 5 или 8 электронов:
Чем более концентрированной является азотная кислота, тем меньшей окислительной способностью по отношению к металлам она обладает.
С другой стороны, чем более активным является металл, тем в большей степени он восстанавливает азотную кислоту.
Примеры реакций азотной кислоты:
Концентрированная азотная кислота пассивирует алюминий, железо и хром, образуя на их поверхности очень прочную нерастворимую оксидную пленку:
2Al+6HNO3 = Al2O3+6NO2+3H2O
«Царская водка» (смесь концентрированной азотной кислоты с соляной в соотношении 1:3) окисляет золото и платину:
Au+3HNO3+3HCl = AuCl3+3NO2+3H2O
Азотная кислота в домашних условиях
Ключевые слова конспекта: азотная кислота, строение молекулы, физические и химические свойства, получение, применение азотной кислоты.
СТРОЕНИЕ МОЛЕКУЛЫ И
ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Высшим гидроксидом азота является азотная кислота HNO3. Азотная кислота – вещество молекулярного строения. В молекуле HNO3 химические связи ковалентные полярные. Графическая формула азотной кислоты:
В азотной кислоте степень окисления азота равна +5, а его валентность – IV. Азот не может быть пятивалентным, так как на втором энергетическом уровне нет вакантных орбиталей, необходимых в этом случае для возбуждения атома. Одна из электронных пар атома азота принадлежит одновременно трём атомам: двум атомам кислорода и атому азота – трёхцентровая связь.
При обычных условиях азотная кислота – бесцветная жидкость, примерно в 1,5 раза тяжелее воды, летуча, «дымит» на воздухе, смешивается с водой в любых соотношениях. Часто концентрированный раствор азотной кислоты окрашен в жёлтый цвет, который придаёт раствору оксид азота (IV) NO2, выделяющийся вследствие частичного разложения HNO3.
ХИМИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Азотная кислота является сильной одноосновной кислотой, в водном растворе диссоциирует на ионы:
Ион Н3O + можно обнаружить в растворе с помощью индикатора: лакмус меняет цвет с фиолетового на красный, метиловый оранжевый – с оранжевого на красный.
Азотная кислота проявляет общие свойства кислот. Она реагирует:
КОН + HNO3 = KNO3 + H2O
OH – + Н + = H2O
Mn(OH)2 + 2HNO3 = Mn(NO3)2 + 2H2O
Mn(OH)2 + 2Н + = Mg 2+ + 2H2O
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
Zn(OH)2 + 2Н + = Zn 2+ + 2H2O
CuO + 2HNO3 = Cu(NO3)2 + 2H2O
CuO + 2Н + = Cu 2+ + H2O
К2СO3 + 2HNO3 = 2KNO3 + CO2↑ + H2O
СО3 2– + 2Н + = CO2↑ + H2O
В то же время в молекуле азотной кислоты содержится атом азота в высшей степени окисления, что обусловливает специфические свойства азотной кислоты.
где Me – металл.
В ходе реакции обычно образуется смесь продуктов восстановления азота, и, как правило, один из них преобладает. Глубину восстановления азота иллюстрирует схема:
Восстановление азота до NO2 является менее глубоким по сравнению с восстановлением до NO и т. д.
Глубина восстановления азота зависит:
С азотной кислотой не реагируют:
Чтобы определить, какой из продуктов восстановления азота преобладает, при записи уравнения реакции можно ориентироваться данными таблицы.
Ещё раз обратим внимание, что в ходе реакции образуется смесь продуктов восстановления и преобладание того или иного продукта зависит от многих факторов.
Классическими примерами взаимодействия азотной кислоты с металлами является растворение меди в азотной кислоте:
ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ АЗОТНОЙ КИСЛОТЫ
В лаборатории чистую азотную кислоту получают нагреванием кристаллической натриевой или калиевой селитры (KNO3, NaNO3) с концентрированной серной кислотой:
Образующиеся пары HNO3 конденсируют и собирают полученный продукт.
В основе промышленного получения азотной кислоты находится цепь синтезов:
Сырьём является азот, получаемый разделением жидкого воздуха на фракции. Сначала осуществляется синтез аммиака:
Аммиак окисляют кислородом на платиновом катализаторе:
Оксид азота (II) легко окисляется кислородом воздуха:
В заключение проводят поглощение диоксида азота водой в присутствии избытка кислорода:
Азотная кислота является одной из важнейших неорганических кислот. Её мировое производство достигает десятков миллионов тонн в год. Азотная кислота применяется для производства минеральных удобрений, нитрования органических веществ во многих органических синтезах (чаще всего для синтеза взрывчатых веществ, красителей и лекарств). Примерами органических продуктов нитрования являются нитробензол (требуется для синтеза анилина), тринитротолуол (тротил, тол), тринитроглицерин (для получения динамита), тринитрофенол (пикриновая кислота – взрывчатое вещество), тринитроцеллюлоза и т. д. Азотная кислота используется для травления металлов.
Всё про азотную кислоту кратко в одной таблице
Всё про азотную кислоту кратко в одной таблице
Конспект урока «Азотная кислота: строение, свойства, получение, применение».
Профессиональное хранение
Но давайте разберёмся, в чём советуют хранить эти кислоты в промышленности (помимо стекла). Вот что гласят инструкции от производителей химреактивов по этому поводу.
Серная кислота
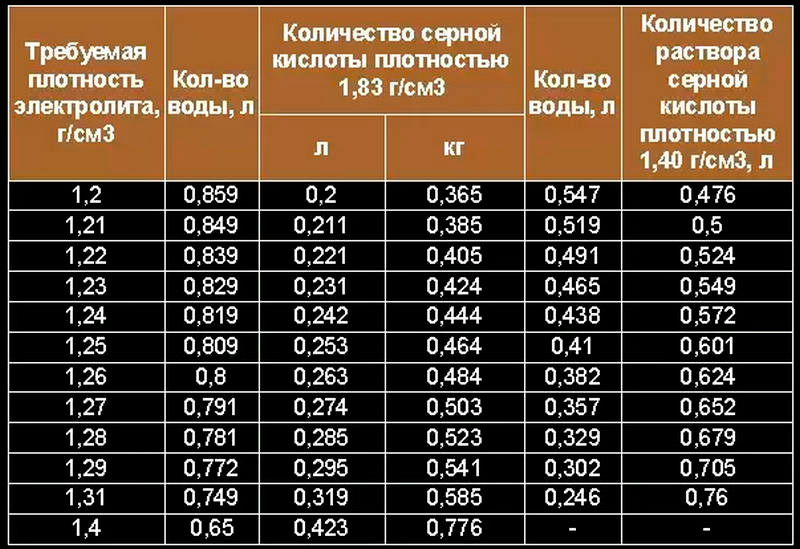
На практике концентрированная серная кислота приводит к коричневению (обугливанию изнутри) PEHD и PP, что, по всей видимости, портит её чистоту. Но зато она через эти пластики не проникает. Тефлон… надо проверять, да и дороговат он. Серная кислота аккумуляторной концентрации (1.27-1.28 г/см 3 ) может в PP-канистре храниться многие годы, канистра не коричневеет, количество кислоты не уменьшается (если, конечно, крышка нормально-плотно завинчена).
Соляная кислота
Как показал опыт и эксперименты, все эти промышленные методы хранения годятся только для непродолжительного хранения или транспортировки («в бочках и цистернах»). Сохранить в течение многих лет соляную кислоту, наверное, получится только в стеклянной таре со стеклянной же пробкой (и непонятно какой смазкой: кто-то использует силиконовое масло).
Через фторопласт (= тефлон, PTFE) соляная кислота просачивается, также как и через PP/PEHD, и оный тоже коричневеет.
Азотная кислота
Банальные ПВХ, фторопласт, алюминий — вот в чём, оказывается, надо хранить азотную кислоту. В тефлоновых контейнерах ещё (бывают такие, но они маленькие и почти непрозрачны). Или тогда уж проще купить стеклянный флакон с тефлоновой пробкой. И совсем уж просто и дёшево — тефлоновую пробку. Или самому вырезать нужной формы и диаметра на токарном станке из PTFE-стержня.
Азотная кислота широко используется в различных сферах:
Кислоты в Беларуси применяются активно, поскольку многие процессы без их участия попросту невозможны. Важно помнить, что они являются опасными и едкими веществами, поэтому при работе с реактивами необходимо соблюдать технику безопасности.
Применение азотной кислоты
Азотная кислота в промышленности широко применяется для получения лекарств, красителей, взрывчатых веществ, азотных удобрений и солей азотной кислоты. Кроме того, она используется для растворения металлов (например, медь, свинец, серебро), которые не реагируют с другими кислотами. В ювелирном деле используется для определения золота в сплаве (это способ является основным).
В органическом синтезе широко применяется смесь концентрированной азотной кислоты и серной кислоты — «нитрующая смесь».
В металлургии азотная кислота применяется для растворения и травления металлов, а также для разделения золота и серебра. Также азотную кислоту применяют в химической промышленности, в производстве взрывчатых веществ, в производстве полупродуктов для получения синтетических красителей и других химикатов.
Кислота азотная техническая используется при никелировании, гальванизации и хромировании деталей, а также в полиграфической промышленности. Широко используется кислота азотная в молочной, электротехнической промышленности.
Уксусом или лимонкой
Удалить ржавчину с металла можно даже с помощью этих кислот. Способ очистки прост и безопасен. Металлическое изделие помещают в раствор лимонной кислоты (на 2,5 л воды будет достаточно пары 20-граммовых пакетиков). Большие поверхности обрызгивают пульверизатором.
Время выдержки зависит от степени повреждения металла. Как правило, оно составляет не больше суток. Можно поступить по-другому. Выдержать деталь в растворе пару часов, а затем размягченный слой потереть металлическим ершиком или фольгой. Он легко отойдет. Для ускорения процесса раствор лимонной кислоты можно предварительно вскипятить.
Еще одним преимуществом обработки лимонной кислотой является возможность дальнейшей оцинковки без предварительной очистки. На фосфатную же пленку, образующейся в результате взаимодействия «ржи» с ортофосфатной кислотой, цинк не ляжет. Плюсом является и то, что лимонка не затрагивает лакированные или окрашенные покрытия.
Обработка с помощью уксуса осуществляется точно также. Чем больше его концентрация, тем лучше. Можно использовать даже 70-процентный его раствор. При добавлении к уксусу обычной соли (ее насыпают столько, чтобы она перестала растворяться) эффект усилится. Если слой налета большой, перед тем, как очистить ржавчину с помощью кислоты, поверхность можно обработать железной щеткой или наждачкой.
Азотная кислота
Азотная кислота
Азотная кислота (HNO3) — одна из сильных одноосновных кислот с резким удушливым запахом, чувствительна к свету и при ярком освещении разлагается на один из оксидов азота (ещё называемый бурым газом — NO2 ) и воду. Поэтому её желательно хранить в тёмных ёмкостях. В концентрированном состоянии она не растворяет алюминий и железо, поэтому можно хранить в соответствующих металлических ёмкостях.
Азотная кислота — является сильными электролитом как многие кислоты) и очень сильный окислитель. Её часто используют при реакциях с органическими веществами.
Безводная азотная кислота — бесцветная летучая жидкость (t кип=83 °С; из-за летучести безводную азотную кислоту называют «дымящей») с резким запахом.
Один объем азотной и три объема соляной кислоты образуют соединение, называемое «царской водкой». Она способна растворять металлы (платину и золото), нерастворимые в обычных кислотах. При внесении в эту смесь бумаги, соломы, хлопка, произойдёт энергичное окисление, даже воспламенение.
При кипячении она раскладывается на составляющие компоненты (химическая реакция разложения):
HNO3 = 2NO2 +O2 + 2H2O — выделяется бурый газ (NO2), кислород и вода.

(при нагревании выделяется бурый газ)
Cвойства азотной кислоты
Cвойства азотной кислоты могут быть разнообразными даже при реакциях с одним тем же веществом. Они напрямую зависят от концентрации азотной кислоты. Рассмотрим варианты химических реакций.
— азотная кислота концентрированная:
С металлами железом (Fe), хромом (Cr), алюминием (Al), золотом (Au), платиной (Pt), иридием (Ir), натрием (Na) — не взаимодействует по причине образования на их поверхности защитной плёнки, которая не позволяет дальше окисляться металлу.
Со всеми остальными металлами при химической реакции выделяется бурый газ (NO2). Например, при химической реакции с медью (Cu):
4HNO3 конц. + Cu = Cu(NO3)2 + 2NO2 + H2O
С неметаллами, например с фосфором:
5HNO3 конц. + P = H3PO4 + 5NO2 + H2O
— разложения солей азотной кислоты
В зависимости от растворённого металла разложение соли при температуре происходит следующими образом:
Любой металл (обозначен как Me) до магния (Mg):
MeNO3 = MeNO2 + O2
Любой металл от магния (Mg) до меди (Cu):
MeNO3 = MeO + NO2 + O2
Любой металл после меди (Cu):
MeNO3 = Me + NO2 + O2
— азотная кислота разбавленная:
— химическая реакция с оксидами металлов, например, оксид кальция:
2HNO3 + CaO = Ca(NO3)2 + H2O — образуется соль (нитрат кальция) и вода
— химическая реакция с гидроксидами (или основаниями), например, с гашеной известью
2HNO3 + Ca(OH)2 = Ca(NO3)2 + H2O — образуется соль (нитрат кальция) и вода — реакция нейтрализации
— химическая реакция с солями, например с мелом:
2HNO3 + CaCO3 = Ca(NO3)2 + H2O + CO2 — образуется соль (нитрат кальция) и другая кислота (в данном случае образуется угольная кислота, которая распадается на воду и углекислый газ).
Только контактные линзы acuvue moist помогут вам со зрением.
Инструменты и реагенты для практического получения вещества
Для проведения реакции потребуется наличие:
Получение азотной кислоты в домашних условиях, как и проведение любой другой химической реакции, требует соблюдения мер предосторожности:
Теперь вы знаете, как получить азотную кислоту в процессе проведения простой реакции. Будьте осторожны с использованием такого вещества и применяйте его только в мирных целях.
Как получить азотную кислоту
Ее хранят в темных емкостях. Свет не любит азотная кислота. При ярком освещении вещество разлагается на бурый газ – один из оксидов азота, и воду.
В полумраке же, кислота с водой легко смешивается в любых пропорциях. У вещества есть и кристаллическое состояние.
Оно может быть моноклинным и ромбическим. Это указывает на форму ячеек кристаллической решетки.
Моноклинная составлена из наклоненных параллелепипедов, а ромбическая, соответственно, из ромбов.
Отличаются ли свойства растворов кислоты от ее кристаллов, как вещество добывается и где применяется? Вопросы заданы, остается дать на низ ответы.
Свойства азотной кислоты
В обычных условиях кристаллическую кислоту можно лицезреть лишь в жарких странах.
В твердое состояние бесцветная жидкость переходит лишь при 42-ух градусах Цельсия. До этой отметки вещество остается жидким и парит.
При этом, реагент источает резкий, удушливый запах. С ним, собственно, связана история открытия азотной кислоты. Обнаружил ее Даниэль Резерфорд.
Шотландец изучал продукты сжигания серы, угля, фосфора. В ходе работ выделялся газ, который химик назвал удушливым воздухом.
Ученый отметил, что вещество не поддерживает горение и непригодно для дыхания.
Позже, выяснилась формула азотной кислоты: — HNO3. Получается, вещество одноосновное.
Так именуют кислоты, в состав которых входит лишь один атом водорода. С водой вещество смешивается в любых пропорциях.
Поэтому, существует концентрированная азотная кислота и неконцентрированная.
Первая активно дымит, то есть, летуча. Химические свойства концентрата разнятся с разбавленой версией.
Если кислоты в растворе около 60%, он будет реагировать со всеми металлами кроме алюминия, железа, иридия, хрома, натрия, золота и платины.
Отсюда вывод, в какой таре нужно хранить вещество. Золотые и платиновые фляги, конечно, не выгодны.
А вот емкости из железа и алюминия и бюджетны, и надежны, поскольку закрывают кислоту от света. Главное, не выбрать тару из меди. Азотная кислота ее растворит.
Реагируя с металлами, концентрированный раствор азотной кислоты выделяет бурый газ. Его формула: — NО2.
Параллельно, образуются соли кислоты. В зависимости от растворенного металла, реакции разнятся.
При взаимодействии с рядом до магния, образуются диоксиды, и выделяется кислород.
Реакция с солями металлов, находящимися после магния до меди, дает бурый газ, оксид азота и кислород.
Если к кислоте присоединится соль любого металла после меди, металл отделится. Вместе с ним выделяются бурый газ и кислород.
Разбавленная азотная кислота реагирует с большинством тех же металлов, но, окисляется при этом до аммиака.
К такому исходу приводит взаимодействие, к примеру, с цинком и элементами щелочноземельной группы. В реакцию вступает и железо.
Так что, разбавленную кислоту в емкостях из сплавов с феррумом лучше не хранить.
Самый редкий вариант – закись азота. Ее даст, к примеру, реакция с магнием. С остальными металлами азотная кислота образует оксид азота.
Его можно получить, в частности, при взаимодействии с серебром. Выпадет оксид аргентума, образуется вода и оксид азота.
По этой же схеме проходят реакции кислоты с неметаллами, только, вместо солей формируется серная кислота.
Из реакций с другими кислотами примечательно смешивание с соляной. Последней, берут 3 части, а первой – одну. Получается царская водка.
Ее так назвали, поскольку вещество растворяет даже золото – металл правителей, сильных мира сего.
На такое не способна ни одна из чистых кислот. Благородные металлы им поддаются редко, а золото, вовсе, никогда.
Добыча азотной кислоты
В малых количествах вещество возможно добывать даже из воздуха, причем, в прямом смысле. Не секрет, что азот – одна из составляющих атмосферы.
Он-то и реагирует с водой, взвесь которой, как известно, имеется в воздухе. Вступая в контакт с облаками, туманом, бурый газ переходит в азотную кислоту.
Массовая доля азотной кислоты в атмосфере столь мала, что вещество не наносит вред человеку, да и другим живым организмам.
Для промышленной добычи кислота из воздуха тоже не годится. На заводах пользуются иными схемами.
Первая: — производство азотной кислоты из аммиака. Сначала, проводят его конверсию, то есть, дробление состава исходной газовой смеси.
Реакция проходит на платинородиевых сетках при температуре около 1000 градусов Цельсия. Так получают оксид азота. Его окисляют до диоксида.
Это вторая стадия процесса. После, оксиды азота абсорбируют водой. В итоге, получается азотная кислота и чистая вода.
Описанный метод приводит к образованию разбавленной кислоты. Возможна последующая концентрация.
Поэтому, метод наиболее популярен, ведь потребителям нужна, как насыщенная, так и ненасыщенная кислоты.
Работая с аммиаком, промышленники «убивают одним выстрелом двух зайцев».
Второй метод производства реактива приводит сразу к получению концентрата. Речь о прямом синтезе из оксидов азота. Берут жидкие.
Они взаимодействуют с водой и кислородом. Такие реакции с азотной кислотой проходят под давлением в 5 мегапаскалей.
Получается диоксид азота. В обычных условиях он переходит в жидкое состояние. Окисление аммиака дает двойной оксид азота.
В газовой смеси его около 11%. Сжижжают диоксид под давлением. При стандартных условиях переход невозможен.
Применение азотной кислоты
Как составная царской водки азотная кислота является частью пробирных кислот. С их помощью изучают качество золота.
Без соответствующих исследований слитки не поступят в банки, а украшения – на прилавки магазинов.
Прежде чем апробировать и продать драгоценный металл, его нужно добыть. В этом тоже помогают азотная кислота и царская водка.
Ими обрабатывают руды, выводя нужные элементы в раствор. Остается осадить металлы и осушить, очистить от примесей. Так добывают не только благородные, но и неблагородные элементы.
Из металлов, как известно, делают сплавы, а из них, к примеру, технику. Если рассматривать воздушную и космическую, в них присутствует чистая кислота.
Ее примешивают к топливу, получая оксид. Азотная кислота выступает в роли окислителя.
В его присутствии процесс сгорания эффективнее, выделяется больше тепла. Так что, часть реагента производят для ракетного топлива.
Соль азотной кислоты – сырье для производства удобрений. Наиболее популярны: нитрат кальция, нитрат натрия, нитрат аммония и нитрат калия.
Все это соли, объединенные названием «селитры». Азот позволяет растениям быстро развиваться, повышает урожайность.
Дело в том, что 15-ый элемент входит в состав хлорофилла. Это зеленый пигмент растений, отвечающий за усвоение энергии Солнца.
Чем больше освоенной энергии, тем лучше развитие трав, кустарников, деревьев.
Слово «селитра» на слуху и у пиротехников. Азотная кислота – основа взрывчатых веществ.
Цена азотной кислоты
Азотная кислота, как и большинство востребованных кислот, бывает чистой и технической, отягощенной примесями. Последняя дешевле.
Чистый реагент дороже. Для справки, ГОСТ 4461-77 – норма для очищенной кислоты.
Реагент российского производства стоит в районе 30-55-ти рублей за килограмм. Ценник зависит от концентрации раствора.
Для технической кислоты верхний ценовой предел, обычно, составляет 40 рублей за кило. Предусмотрена и большая фасовка.
Есть, к примеру, 25-литровые канистры, в которые разливается азотная кислота.
Купить реагент с максимальной выгодой позволяют оптовые заказы. Такие уходят на предприятия, где знают правила обращения с реагентом.
Он разъедает не только металлы, но и слизистые. Пары вещества могут затруднить дыхание, повредить трахеи, выстилающие ткани носа.
Поэтому, с кислотой работают лишь в масках. При нарушении правил, кроме трудностей с дыханием, наступает отравление.
Интоксикация выражается в рвоте, чесотке, нарушениях зрения, обоняния. Более-менее безобидны лишь слабые растворы реагента.
Именно такие, к примеру, используют в школьных лабораториях. Учиться обращению с химическими реагентами стоит с малых лет.
Как сделать азотную кислоту
Познавательно – развлекательный ресурс
Вещи, собранные своими руками, приносят особое удовлетворение их изготовителям, если с помощью них можно извлечь или познавательную, или практическую пользу. Это приятно всегда.
Простое переговорное устройство на две персоны можно собрать за несколько минут. Для этого понадобятся два телефонных капсюля от старых телефонов и моток двужильного провода большого сечения (для уменьшения затухания сигнала), если хотим протянуть линию до 100 м. Всё ясно из рисунка.
Принцип действия: эдс, создаваемая колебанием мембраны одного телефона заставляет колебаться мембрану другого телефона и мы слышим источник звука с достаточной громкостью для общения.
Недостаток симплексной связи – надо говорить и слушать по очереди. Этот недостаток можно устранить, собрав второй комплект вечного телефона и соединить согласно следующего рисунка, однако при этом материалов понадобится ровно в два раза больше.
Вместо телефонов можно использовать старые абонентские динамики, наушники с высокой добротностью. Подключив параллельно линии через кнопку низковольтный источник питания, например квадратную батарейку, можно сделать подобие звонка, только вместо телефонной трели будут раздаваться щелчки.
2. Как сделать макрофотографии обычным мобильником
Очень просто. Достаточно скотчем прикрепить увеличительную линзочку с малым фокусным расстоянием к объективу мобильника или фотокамеры. Чем меньше фокусное расстояние линзы, то есть, чем сильнее увеличивает она, тем с большим увеличением можно сфотографировать в фокусе микрообъект. Линзы можно демонтировать со старых фотоаппаратов или другой техники с оптикой.
Ниже я привожу снимки, сделанные мобильником BlackBerry Storm 9500 с камерой на 3.2 мегапиксела с прикрепленной линзой.
3. Как сделать азотную кислоту в значительном количестве
Как-то мне понадобилась азотная кислота с пол-литра.
Здесь, на юге Испании, поиски в различных магазинов не дали результатов, по почте это высылать не будут ввиду… И вот после тщательного поиска в интернете я нашел приемлемый способ получения азотки в нужном количестве и хорошего качества и что немаловажно концентрированной. Привожу рисунок и текст из химпособия. Авось сгодится еще кому.
Роль реторты в этой модели завода по получению HNO3 выполняет эмалированный кофейник( или чайник). Чтобы крышка кофейника не пропускала паров азотной кислоты, между крышкой и краями кофейника помещается прокладка из асбестового картона.
Кружок асбеста смачивается водой и зажимается между краями кофейника и крышкой. После того как прокладка таким образом сформирована, ее вынимают вместе с крышкой и просушивают.
Не следует забывать, что только концентрированная азотная кислота делает железо пассивным и на него не действует, а в эмали всегда могут быть трещины. Поэтому влажную прокладку применять нельзя.
Для того, чтобы плотно прижать крышку к краям кофейника, служит приспособление, состоящее из двух петель, сделанных из медной проволоки, обвивающий верхний рант кофейника. В петли вставляются концы деревянной планки, в середину которого ввинчен шуруп.
Если шишечка составляет с крышкой одно целое, то конец шишечки нужно спилить напильником, чтобы получилась плоскость для упора винта.
К «реторте» присоединен холодильник из лампового стекла и «конденсационные горшки» в виде двугорлых склянок.
Все соединения должны быть сделаны без пробок и резины. Вместо пробок можно воспользоваться асбестовой ватой. Трубка а вставляется в носик кофейника поглубже и затем в носик изнутри забивается асбестовая вата. Для этого удобно воспользоваться загнутым на конце в виде крюка большим гвоздем и т.п.
В двухгорлые склянки трубки вставляются тоже на асбестовой вате. На трубку навертывается жгут из ваты и затем плотно забивается в отверстие склянки. Соединения с кофейником должны быть сделаны при помощи сухого асбеста (см. Выше), для остальных же соединений асбест можно взять влажный, благодаря чему без особых затруднений получаются достаточно плотные соединения.
Первая из склянок оставляется пустой, во вторую наливается немного воды, в последнюю вода наливается до половины, а трубка слегка погружается в воду. В первой банке собирается главная масса азотной кислоты, во второй – поглощается большая часть паров,в третьей же – удерживаются остальные пары. Если прибор можно поместить под тягу, то третью склянку можно и не ставить.
Если все соединения сделаны аккуратно, то во время работы пары азотной кислоты почти совсем не выделяются из прибора.
Вместо двугорлых склянок можно взять и обыкновенные. Тогда обе вставленные трубки сначала обвивают асбестовой ватой, каждую отдельно, затем вместе и вставляют одновременно.
В кофейник насыпать селитры KNO3 или NaNO3 почти до половины высоты, прилить столько концентрированной серной кислоты H2SO4, чтобы после размешивания получилась кашицеобразная масса, крышку закрыть и начать нагревание. Воду в холодильник лучше пустить непрерывной струей, но можно и подливать по мере надобности.
Схема очень простая и описана во многих пособиях по химии.
Электрохимическое осаждение благородных и других металлов
265 секретов производстенных технологий 1992г
Чтобы сделать медь мягкой – накалить до малинового цвета и охладить в воде.
Сделать медь твердой – нагреть до 400°С и медленно охладить (т.е. с печкой).
Большая Рнциклопедия Нефти Рё Газа
Получение концентрированной азотной кислоты, как отмечалось выше, связано с гидролизом четырехокиси азота ( по мнению авторов, двуокиси азота) водой и образованием наряду с азотной азотистой кислоты, которая в концентрированных растворах частично окисляется непосредственно в жидкой фазе, а в разбавленных растворах преимущественно разлагается с выделением NO. Окись азота при окислении кислородом образует двуокись и че-тырехокись азота. [3]
Получение концентрированной азотной кислоты, как отмечалось выше, связано с гидролизом четырехокиси азота ( по мнению авторов, двуокиси азота) водой и образованием наряду с азотной кислотой азотистой кислоты, которая в концентрированных растворах частично окисляется непосредственно в жидкой фазе, а в разбавленных растворах преимущественно разлагается с выделением NO. Окись азота при окислении кислородом образует двуокись и четырехокись азота. В зависимости от условий процесса взаимодействия жидких окислов азота с водными растворами азотной кислоты и кислородом реакция, контролирующая скорость процесса, может быть различной. [4]
Для получения концентрированной азотной кислоты ( более 68 % HNOs) обычно применяют перегонку разбавленной азотной кислоты РІ присутствии крепкой серной кислоты, как водоотнимающего средства. Крепкая серная кислота СЃРІСЏ-зываег РІРѕРґСѓ, содержащуюся РІ разбавленной азотной кислоте, образуя гидраты серной кислоты, кипящие РїСЂРё температуре, более высокой, чем 100 % – ная HNO3, поэтому РїСЂРё нагревании такой смеси можно подобрать условия, РїСЂРё которых РІ парах будет содержаться почти исключительно азотная кислота. [6]
Для получения концентрированной азотной кислоты можно удалять РІРѕРґСѓ РёР· разбавленных кислот кипячением, РЅРѕ система РќРњРћР· – Рќ2Рћ образует нераздельнокипящую ( азеотропную) СЃ месь.
РќР° практике кипячением слабых кислот получают примерно 65 % – РЅСѓСЋ азотную кислоту, которая мало отличается РѕС‚ HNO3, получаемой после РІРѕРґРЅРѕР№ абсорб-ции РїРѕРґ давлением.
Поэтому для получения концентрированной кислоты применяют во-доотнимающие средства. [7]
Для получения концентрированной азотной кислоты используются также установки, работающие с применением так называемых инверсионных газов.
РќР° этих установках для получения окислов азота используются растворы азотистокислых Рё азотнокислых солей, которые инвертируются ( расщепляются) непрерывным СЃРїРѕСЃРѕР±РѕРј разбавленной ( 42-процентной) азотной кислотой РІ специальных аппаратах – инверсионных колоннах. Кислота РІ колонне подогревается РґРѕ 65 РЎ, соли – – РґРѕ 105 РЎ. Для выделения образовавшейся РѕРєРёСЃРё азота колонну продувают РІРѕР·РґСѓС…РѕРј. Окисление РѕРєРёСЃРё азота РїСЂРѕРёСЃС…РѕРґРёС‚ РІ окислительной колонне РїРѕРґ действием паров 45-процентной азотной кислоты Рё жидкой азотной кислоты концентрацией 59 Рё 66 %, нагретой РґРѕ температуры 110 – 125 РЎ. [8]
Для получения концентрированной азотной кислоты ( более 68 %) обычно перегоняют разбавленную азотную кислоту в присутствии крепкой серной кислоты как водоотнимающего средства.
Крепкая серная кислота связывает РІРѕРґСѓ, содержащуюся РІ разбавленной азотной кислоте, образуя гидраты серной кислоты, кипящие РїСЂРё температуре более высокой, чем 100 % – ная РќРњРћР·.
Диаграмма кипения. [11]
ПОИСК
Одним из таких полупродуктов является водород, который образуется в процессе крекинга и пиролиза нефти и углеводородных газов. Водород в свою очередь служит исходным веществом для производства аммиака, в молекуле которого на один атом азота приходится три атома водорода.
Из аммиака получают углекислый аммоний, сульфат аммония, азотную кислоту, аммиачную селитру и ряд других продуктов, широко используемых в качестве удобрений и в химической промышленности для производства ряда веществ. Кроме того, из аммиака получается мочевина, представляющая собой органическое вещество, содержащее азот.
В последнее время мочевина стала широко применяться в качестве удобрения, добавок в корм скоту, а также для производства некоторых пластмасс. Водород, который является основой синтеза аммиака, может получаться разными путями — при крекинге и пиролизе нефти и газа, при обработке кокса и угля водой при высокой температуре, при электролизе воды и т. д.
Наиболее выгодным оказалось получение водорода из углеводородного газа. [c.356] Получение концентрированной азотной кислоты нз селитры. К находящейся в реторте высушенной селитре прибавляют одну треть эквимолекулярного количества концентрированной серной кислоты и смесь нагревают в вакууме на водяной бане.
По мере того как нз реторты отгоняется азотная кислота уд. в. 1,. 53 (при 15°), к смеси постепенно прибавляют остальное количество сериой кислоты. По окончании перегонки в реторте остается бисульфат. [c.232]
Плавиковый шпат разлагается сплавлением с едким кали в золотом тигле или с карбонатом калия и селитрой в платиновом тигле и последующей обработкой плава водой или холодной разбавленной азотной кислотой.
Полученные этими способами плавы растворяются значительно легче, чем плавы, получаемые в результате сплавления с соответствующими солями натрия. Когда не требуется определение фтора, плавиковый шпат можно разлагать нагреванием тонкого порошка пробы с серной или хлорной кислотой или же обработкой при нагревании разбавленной (1 1) соляной кислотой, содержащей борную кислоту. [c.822]
и время от времени поливали эту массу навозной жижей до тех пор, пока в ней не образовывалось в результате разложения органических веществ достаточного количества нитрата кальция и других азотнокислых солей, которые затем подвергали выщелачиванию. В настоящее время нитрат кальция получают нейтрализацией его карбоната (известняка) или гидроокиси технической азотной кислотой.
Азотная кислота и ее соли. Получение азотной кислоты из селитры и окислением аммиака. Свойства азотной кислоты. Действие концентрированной и разбавленной азотной кислоты на металлы. Отношение солеи азотной кислоты к нагреванию. [c.44]
Существенный аспект топливно-энергетической проблемы — это повыщение эффективности использования топливных ресурсов, в частности возможно более полное использование всех видов энергии. Известно, что химическая промышленность и смежные с ней отрасли являются крупнейшими потребителями тепловой и электрической энергии.
В последние годы особенно большое внимание уделялось снижению всех видов энергозатрат в химико-технологических процессах — прежде всего уменьшению теплопотерь и наиболее полному использованию реакционной теплоты. Одним из путей повышения энергетической эффективности химико-технологических процессов служит химическая энерготехнология, т. е.
организация крупномасштабных химико-технологических процессов с максимальным использованием энергии (прежде всего теплоты) химических реакций.
В энерготехнологических схемах энергетические установки — котлы-утилизаторы, газовые и паровые турбины составляют единую систему с химико-технологическими установками химические и энергетические стадии процесса взаимосвязаны и взаимообусловлены.
Химические реакторы одновременно выполняют функции энергетических устройств, например вырабатывают пар заданных параметров. Энерготехнологические системы реализуются прежде всего на базе агрегатов большой мощности — крупнотоннажных установок синтеза аммиака, синтеза метанола, производства серной кислоты, азотной кислоты, получения карбамида, аммиачной селитры и т. д. [c.37]
ПОЛУЧЕНИЕ АЗОТНОЙ КИСЛОТЫ ИЗ СЕЛИТРЫ [c.135]
Заводский способ получения азотной кислоты из селитры [c.138]
Недостаточно была развита азотная промышленность, на которой базировалось производство химикатов для получения взрывчатых веществ — синтетического аммиака, азотной кислоты, аммиачной селитры и некоторых других продуктов. Кроме того, Германия превосходила США в выпуске синтетических красителей и искусственных волокон — химических продуктов, имеющих важное военное значение. [c.86]
Получение азотной кислоты из селитры [c.130]
Получение азотной кислоты, аммиачной селитры, мочевины и капролактама сопровождается выделением весьма агрессивных по отношению к строительным конструкциям веществ.
Вместе с тем степень загрязнения воздушного пространства не столь велика, чтобы препятствовать размещению рядом других производств, в том числе и производства аммиака — основного сырья для них, а также зданий подсобно-производственных и вспомогательных служб и различных инженерных сооружений. При определении места для сооружений каждого производства в отдельности и всего предприятия в целом надо учитывать не только схему технологического процесса и связь между отделениями, но и преобладающее направление ветра. Производства с вредными выбросами должны располагаться с подветренной стороны по отношению к остальным зданиям и сооружениям. [c.281]
Наконец, третий способ получения азотной кислоты — из селитры — являлся в прошлом единственным, но теперь почти не имеет промышленного значения, В его основе лежит взаимодействие селитры с концентрированной серной кислотой [c.253]
Качество аммиачной селитры должно отвечать требованиям ГОСТ 2-40, приведенным в табл. 8. Оно зависит, главным образом, от наличия примесей в исходном сырье.
При применении азотной кислоты, полученной поглощением окислов азота промышленной водой, ряд примесей последней, перейдя в азотную кислоту, загрязняет нитрат аммония (силикаты, железо, кальций и др.).
При получении нитрата аммония из очищенного кок-собснзольного аммиака почти всегда в готовом нитрате аммония имеются примеси сернокислых солей и органических соединений. [c.24]
Начиная с XV и до начала XIX в.
азотную кислоту получали одним методом смесь селитры с железным купоросом или квасцами прокаливали в небольших глиняных ретортах и выделяющиеся при этом пары азотной кислоты конденсировали в концентрированную азотную кислоту.
В России первая запись о получении азотной кислоты из селитры принадлежит Петру I. Уже в это время азотная кислота применялась в текстильном, аптечном деле, для разделения золота и серебра, а также для крашения ружейных лож. [c.5]
Опыт 7. Окислительные свойства азотной кислоты. Для показа окислительных свойств азотной кислоты следует использовать концентрированную азотную кислоту, полученную взаимодействием селитры с серной кислотой. Продажная азотная кислота, имеющаяся в распоряжении школьной химической лаборатории, для этих целей непригодна, так как она содержит много воды. [c.157]
Вы уже встречались с применением метода кипящего слоя для ускорения обжига серусодержащего сырья и контактного окисления SO2. Вспомнив эффективность этих процессов, вы, возможно, предложите его и для охлаждения гранул селитры.
Такой способ нашел в последние годы широкое применение в промышленности. В качестве охлаждающего вещества целесообразно применять воздух. Однако, учитывая большой перепад температур воздуха и гранул, вряд ли можно рассчитывать сразу на охлаждение гранул до необходимой температуры.
Как же усовершенствовать охлаждение Для этого можно организовать охлаждение гранул в два приема сначала воздухом при обычной температуре, затем — холодным воздухом, пропущенным предварительно через аммиачный холодильник (жидкого аммиака на заводе много, а для получения азотной кислоты и селитры требуется газообразный аммиак). [c.134]
В России первые прописи по производству азотной кислоты из селитры были составлены при Петре I. Гениальный русский ученый М. В. Ломоносов впервые в нашей стране провел тщательные исследования условий получения азотной кислоты из селитры и в 1763 г. описал их в своих трудах. [c.11]
П. КОНТРОЛЬ ПРОИЗВОДСТВА ПРИ ПОЛУЧЕНИИ АЗОТНОЙ кислоты из СЕЛИТРЫ [c.122]
Крупнейшие предприятия азотной промышленности выпускают большое количество аммиака, аммиачной воды, азотной кислоты, аммиачной селитры, карбамида (мочевины), сложных удобрений, метилового спирта, капролактама и др.
Связанный азот, в первую очередь аммиак и азотная кислота, необходимы при производстве множества химических продуктов анилиновых красителей, взрывчатых веществ, серной кислоты (по нитрозному способу), окислителей, химикатов для фотографии и для получения полиамидных синтетических волокон, пластмасс и других полимерных материалов. [c.7]
Синтетический аммиак и продукты, получаемые на его основе, имеют исключительно важное значение в развитии многих отраслей промышленности и особенно в поднятии урожайности сельскохозяйственных культур.
Аммиак применяется для получения азотной кислоты, аммиачной селитры, мочевины, сульфата аммония, жидких удобрений, используется в холодильной технике, медицине и других отраслях народного хозяйства. [c.
Получение азотной кислоты из селитры и серной кислоты в XIX — начале XX в. являлось единственным производственным способом ее изготовления. В настоящее время этот способ не имеет промышленного значения. По этому способу азотную кислоту получают лишь в лабораторных условиях путем нагревания нитрата натрия с серной кислотой [c.229]
Азотная кислота была известна уже первым алхимикам. Метод получения ее нагреванием смеси селитры, медного купороса и квасцов был описан в VHI в. Гебером (Джафаром).
Позже азотную кислоту стали получать действием серной кислоты на селитру.
В настоящее время метод производства азотной кислоты из селитры заменен наиболее прогрессивным методом контактного окисления аммиака, путь к которому исторически протекал следующим образом. [c.83]
Азотная кислота известна человечеству с VIII века. Она стала первой минеральной кислотой, которую использовали в ремесленной практике. Первое упоминание о ней содержится в трудах арабского ученого Гебера (778 год), указавшем способ получения азотной кислоты перегонкой смеси селитры с квасцами.
Получение азотной кислоты нагреванием смеси селитры с квасцами или купоросом было описано итальянским ученым В. Бирингуччо (1540 год) и Г. Агриколой (1556 год). В 1648 году И. Глаубер получил азотную кислоту нагреванием селитры с серной кислотой, а в 1763 году М.В. Ломоносов исследовал и описал этот метод ее получения.
[c.210]
Получение азотной кислоты взаимодействием селитры с концентрированной серной кислотой является старейшим способом. С появлением метода производства синтетического аммиака азотную кислоту стали получать каталитическим окислением аммиака кислородом воздуха с последующей абсорбцией образующихся окислов азота водой при атмосферном давлении.
Реакция окисления окиси азота в двуокись и абсорбция NO2 проходят эффективнее при повышенном давлении. Однако в то время отсутствовали конструкционные материалы, выдерживающие действие азотной кислоты и давления. С появлением таких материалов в начале 20-х годов фирмой Du Pont (E. I.) de Nemours and o.
был разработан процесс получения азотной кислоты при давлении 8 ат [66]. [c.357]
Контрольные вопросы. 1. Охарактеризовать подгруппу азота с точки зрения электронного строения. 2. Как получается азот в лабораторных условиях и в промышленности З- Какие важнейшие водородные и кислородные соединения азота вам известны Дать их краткую характеристику. 4.
Каким характерным свойством отличается азотная кислота от других кислот 5. Какие азотные удобрения применяются в сельском хозяйстве 6. Определить процентное содержание азота в следующих важнейших азотных удобрениях а) чилийской селитре б) аммиачной селитре в) норвежской селитре г) сульфате аммония д) цианамиде. 7.
Как различить растворы нитрата и нитрита 8. Какими способами получается аммиак в лабораторных условиях и в промышленности 9. Какой реакцией можно обнаружить ион аммония 10. Какими способами получают азотную кислоту в промышленности 11.
Какие известны виды диссоциации и в чем заключается разница между термической диссоциацией и реакцией разложения 12. Почему при получении азотной кислоты из селитры не применяют соляную кислоту 13. Что является окислителем и что восстановителем при получении азота из нитрита аммония NH4N0s 14.
Почему азотная кислота проявляет только окислительные свойства, а азотистая — окислительные и восстановительные 15. Написать уравнения реакций а) аммиака с серной кислотой б) аммиака с фосфорной кислотой в) гидроокиси аммония с фосфорной кислотой. 16. Написать уравнения реакций взаимодействия NOa а) с водой б) с КОН. 17.
Почему при реакции взаимодействия цинка с разбавленной азотной кислотой аммиак не выделяется в виде газа Что с ним происходит 18. Сколько литров [c.200]
Сала был вдумчивым и трезвым химиком и искал для объяснения химических явлений рациональные пути. Он, так же как и Либавий, считал, что серный спирт spiritus vitrioli), полученный из купоросов и при сжигании серы,— одно и то же веш,ество.
Он объяснил также получение азотной кислоты из селитры тем, что эта кислота вытесняется при действии серной кислоты. Наконец, он впервые правильно объяснил выделение меди на железе из медного купороса тем, что медь уже имелась в растворе.
Его же современники полагали, что здесь имеет место трансмутация металлов. [c.157]
Какими способами получают азотную кислоту в промышленности Какой из способов получения НЫОз применяется в СССР Напишите уравнения реакций получения НМОз.
Почему при получении азотной кислоты из селитры необходимо брать концентрированный раствор серной кислоты, а селитру в виде твердого вещества Сравните температуры кипения Н2304 (98%) и НМОз (100%).
Почему реакционную смесь нельзя сильно нагревать Какой состав азеотропной смеси азотной кислоты с водой Какую температуру кипения имеет водный раствор HNOз этого состава Можно ли путем упаривания увеличить концентрацию 70%-ного (20%-ного) раствора азотной кислоты [c.47]
Выделение избытка кальция вымораживанием. По этой схеме фосфаты разлагаются 47—55 /о ной азотной кислотой, полученный раствор охлаждается и из него выкристаллизовывается (вымораживается) четырехводный нитрат кальция.
Кристаллический осадок Са(ЫОз)2 4НгО отфильтровывается от раствора и далее перерабатывается в кальциевую селитру, содержащую около 15,5% азота.
Основы синтеза азотной кислоты в промышленности
Сырьем для получения азотной кислоты служат аммиак, воздух и вода. Синтетический аммиак в большей или меньшей степени загрязнен примесями. Такими примесями являются катализаторная пыль, смазочное масло (при сжатии поршневым компрессором). Для получения чистого газообразного аммиака служат испарительные станции и дистилляционные отделения жидкого аммиака.
Атмосферный воздух, применяемый в производстве азотной кислоты, забирается на территории завода или вблизи его. Этот воздух загрязнен газообразными примесями и пылью. Поэтому он подвергается тщательной очистке во избежание отравления катализатора окисления аммиака. Очистка воздуха осуществляется, как правило, в скруббере, а затем в двухступенчатом фильтре.
Вода, применяемая для технологических нужд, подвергается специальной подготовке: отстою от механических примесей, фильтрованию и химической очистке от растворенных в ней солей. Для получения реактивной азотной кислоты требуется чистый паровой конденсат.
Методы получения азотной кислоты
Первый завод по производству HNO3 из аммиака коксохимического производства был пущен в России в 1916 г. В 1928 г. было освоено производство азотной кислоты из синтетического аммиака [1].
Катализаторы окисления аммиака
Превосходство платины по активности и селективности над всеми другими видами катализаторов было показано в 1902 г. Оствальдом. Характерно, что активность к реакции окисления аммиака проявляет подавляющее большинство металлов и их соединений, но высокий выход NO (выше 90%) обеспечивают очень немногие из них.
Обладая высокой активностью и селективностью, платина имеет низкую температуру зажигания (около 200 °С), хорошую пластичность.
Недостаток платины – ее быстрое разрушение при высоких температурах под воздействием больших скоростных потоков реагентов и катализаторных ядов.
Это приводит к потерям дорогостоящего катализатора и снижению выхода NO, что и явилось причиной поисков каталитически активных сплавов платины с другими металлами.
Проведенные промышленные испытания показали стабильную работу катализаторов из платины с добавками палладия, а также из тройного сплава Pt-Rh-Pd; это и послужило основанием для их промышленной реализации в России.
Используемые для контактного окисления NH3 катализаторы изготавливают в виде сеток.
Такая форма катализатора удобна в эксплуатации, связана с минимальными затратами металла, позволяет применять наиболее простой и удобный в эксплуатации тип контактного аппарата.
В России применяются сетки из проволоки диаметром 0,09 мм (ГОСТ 3193—74), размер стороны ячейки 0,22 мм, число ячеек на 1 см длины — 32, на 1 см2 — 1024.
Платинородиевые (ГИАП-1) и платинородиевопалладиевые (сплав № 5) катализаторы весьма чувствительны к ряду примесей, которые содержатся в аммиаке и воздухе.
К таким примесям относятся гидриды фосфора и мышьяка, фтор и его соединения, дихлорэтан, минеральные масла, ацетилен, диоксид серы, сероводород и др. Наиболее сильными ядами катализатора являются соединения серы и фтора.
Примеси заметно снижают селективность катализатора, способствуют увеличению потерь платины.
Для поддержания стабильной степени конверсии аммиака необходима тщательная очистка аммиачно-воздушной смеси и от механических примесей, особенно от оксидов железа и пыли железного катализатора синтеза аммиака. Пыль и оксиды железа, попадая на катализаторные сетки, засоряют их, уменьшая поверхность соприкосновения газов с поверхностью катализатора, и снижают степень окисления аммиака.
В процессе реакции окисление аммиака поверхность платиноидных сеток сильно разрыхляется, эластичные нити сеток становятся хрупкими.
При этом поверхность сетки увеличивается примерно в 30 раз Сначала это ведет к повышению каталитической активности катализатора, а затем к разрушению сеток.
Практикой установлены следующие сроки работы катализаторных сеток: для работы под под давлением 0,73 МПа 8-9 мес.
Сырье и способы получения азотной кислоты
Азотная кислота по объему производства занимает среди других кислот второе место после серной кислоты. Все возрастающий объем производства HNO3 объясняется огромным значением азотной кислоты и ее солей для народного хозяйства.
Азотная кислота является одним из исходных продуктов для получения большинства азотсодержащих веществ. До 70-80% ее количества расходуется на получение минеральных удобрений. Также азотная кислота применяется:
Учитывая нужды различных потребителей, промышленностью вырабатывается азотная кислота девяти сортов с концентрацией от 45 до 99 %.
В небольших объемах выпускается реактивная и азотная кислота особой чистоты. В производстве взрывчатых веществ нитрованием органических продуктов применяют концентрированную азотную кислоту.
Для получения удобрений потребляется, как правило, разбавленная азотная кислота.
Основным сырьем для производства неконцентрированной азотной кислоты в настоящее время являются аммиак, воздух и вода. Вспомогательными материальными и энергетическими ресурсами являются катализаторы окисления аммиака и очистки выхлопных газов, природный газ, пар и электроэнергия.
NaNO3 + H2SO4 = HNO3 + NaHSO4
Усовершенствованный вариант этого метода получения азотной кислоты состоял в том, что разложение селитры серной кислотой производилось в вакууме.
При этом температура разложения селитры снижалась до 80-160 0С; продолжительность отгонки кислоты сокращалась до 6 часов и достигался выход азотной кислоты близкий к теоретическому.
Такой способ получения азотной кислоты, целиком зависящий от импорта чилийской селитры, впоследствии был оставлен.
В начале XX века была решена исключительно важная проблема связывания атмосферного азота, что дало человечеству новый неисчерпаемый источник сырья для производства азотсодержащих соединений.
Еще в 1781 г. Кэвендиш в результате электрического разряда в воздухе получил окислы азота. В 1814 г. В.Н. Каразин внес предложение о “низведении электричества с верхних слоев атмосферы для производства селитры”. Первый патент на способ получения азотной кислоты при помощи электрического разряда в воздухе и превращения окислов азота в нитриты и в нитраты был получен в 1859 г.
В 1901 г. Было положено начало фиксации азота воздуха в пламени электрической дуги (дуговой метод). В 1902 г. в США сооружен завод по фиксации атмосферного азота с помощью электрической дуги, возникающей при пропускании между электродами тока силой 0,75 ампер и напряжением 8000 вольт. Из-за несовершенства конструкции печи и большого расхода электроэнергии завод был закрыт в 1904 г.
Производство азотной кислоты дуговым методом интересно тем, что в нем использовали дешевое исходное сырье – воздух. Аппаратурное оформление процесса было довольно несложным. Однако для его осуществления требовалось огромное количество электроэнергии, достигающее 70000 квт´ч на 1 т N2 (это соответствует 64 т условного топлива)
В настоящее время промышленное производство азотной кислоты осуществляется на основе контактного окисления синтетического аммиака. Процесс складывается из двух основных стадий: получение окиси азота и переработка ее в азотную кислоту.
При использовании в качестве катализатора платины выход окиси азота в интервале температур 700-8500С может достигать 97-98%. Катализаторы из платиновых сплавов являются наилучшими для избирательного окисления аммиака в окись азота.
Реакция окисления аммиака до окиси азота идет с незначительным изменением объема, поэтому изменение давления не оказывает существенного влияния на равновесный выход продуктов взаимодействия. Большие величины константы равновесия этой реакции свидетельствуют о практической ее необратимости при промышленных условиях осуществления процесса.
Чистая платина обладает недостаточной прочностью, поэтому применяют сплавы платины с родием и палладием.
Поверхность платиновых сеток в процессе эксплуатации сильно разрыхляются, гладкие блестящие нити становятся губчатыми и матовыми. В результате этого сильно развивается поверхность катализатора, что приводит к повышению его активности.
С течением времени разрыхление поверхности платиновых сеток приводит к их сильному разрушению и большим потерям платины.
Добавление к платине родия и палладия имеет двоякое значение: во-первых, повышается активность катализатора, во-вторых, уменьшаются потери катализатора.
На производство азотной кислоты расходуется в основном аммиак, стоимость его на 70% определяет себестоимость азотной кислоты. Вода служит в основном хладагентом и может быть использована повторно.
Аффинаж золота в домашних условиях: получаем чистый металл из радиодеталей и микросхем разными способами
Аффинажем называется очистка металла от примесей.
Этот процесс состоит из ряда последовательных процессов отделения лишних компонентов физическими и химическими способами.
Некоторые из методов аффинажа, применяемые в промышленности, можно реализовать и в домашних условиях, однако порой затраты на осуществление реакций превосходят прибыль от полученного благородного металла.
В данной статье мы расскажем, как снять и отделить золото от радиодеталей и достать его из микросхем, как сделать это безопасно своими руками.
Где содержится данный драгоценный металл?
Сотни тонн золота ежегодно используются при производстве радиодеталей и компьютерных микросхем. Контакты из этого металла отличаются высокой электропроводимостью, они не подвержены окислению, поэтому нашли широкое применение.

Отметим, что на практике в радиодеталях золота может быть гораздо меньше, чем должно быть по документам (особенно в технической продукции, сделанной после 1989 года).
Способы очистки от примесей
Основной способ выделения чистого металла из смесей, в том числе из различных радиодеталей, заключается в химическом рафинировании. Очень распространено растворение в царской водке (смеси азотной и соляной кислоты) с последующим пропусканием через фильтр и восстановлением.
Метод электролиза
При методе электролиза золото из радиодеталей или любое другое, подвергнутое воздействию серной или соляной кислоты, осаждается на катоде при прохождении через раствор электрического тока.
В промышленности применяют катод из уже очищенного золота, дома можно использовать железный или свинцовый.
Падение силы тока – сигнал, что процесс растворения завершен. Данный метод также является действенным и поэтому достаточно распространенным.
Очистка с помощью йода
Для вытравливания золота с поверхности радиодеталей применяют самый обычный аптечный раствор Люголя – он представляет собой смесь йода и йодида калия. В процессе реакции образуются комплексные анионы, содержащие молекулы золота.
Для увеличения скорости химики добавляют серную или азотную кислоту. Процесс растворения может продолжаться сутками.В дальнейшем благородный металл осаждается из раствора разными способами.
Использование отбеливателя «Белизна»

Это вещество в смеси с соляной кислотой позволяет получить хлор, который в дальнейшем используют для растворения золота с образованием хлорида золота.
После этого в раствор добавляют бисульфат натрия.
По окончании реакции на дне сосуда остаются серые частицы – это и есть золото, которое приобретет естественный цвет после переплавки.
Другой вариант – смешать «Белизну», столовую соль (хлорид натрия) и аккумуляторный электролит, которые представляет собой не что иное, как серную кислоту. Полученная при реакции хлорноватистая кислота растворяет золото – его в дальнейшем нужно восстановить.
Аффинаж «без кислоты»
Распространенные в интернете рецепты получения из радиодеталей и растворения золота «без кислоты» по сути вводят читателей в заблуждение, поскольку кислота (обычно соляная) образуется в результате реакции других веществ.
Кроме того, не все знают о том, что применяемый в подобных случаях аккумуляторный электролит также является кислотой.
Использование перекиси водорода
Извлечение золота из радиодеталей перекисью водорода осуществляется следующим образом.
Данное вещество, по-другому именуемое пергидролем, реагирует с соляной кислотой, растворяя золото. Для этого золотосодержащее сырье заливают кислотой и добавляют перекись.
Образовавшаяся золотохлористоводородная кислота в дальнейшем разлагается на элементы.
Для этого можно использовать термический способ (направить на вещество синее пламя горелки) либо химический. Последний состоит в восстановлении золота путем добавления сульфата железа.
Другие методы извлечения
Существует множество других способов аффинажа, которыми можно собрать золото с микросхем, например, электролитом и аммиачной селитрой.
В данном случае электролит смешивается с аммиачной селитрой – так называется соль азотной кислоты. Полученный состав способен растворить благородный металл.
Большая часть других способов также основана на растворении золота и его последующем восстановлении.
Процессы различаются по:
Пошаговая инструкция добычи металла из радиодеталей и микросхем
Для извлечения золота из микросхем и радиодеталей целесообразно воспользоваться царской водкой.
Чтобы аффинировать золото данным способом необходимо осуществить действия в указанной ниже последовательности:
В дальнейшем золото может быть восстановлено с помощью железного купороса, пергидроля, щавелевой кислоты или сульфата гидразина. Полученное золото переплавляется в слиток с использованием тигля.
Отметим, что в домашних условиях заниматься очисткой золота небезопасно из-за значительной едкости и токсичности используемых веществ и выделяющихся летучих соединений.
Кроме того, потребуются углубленные познания в химии.
Куда сдать полученный материал и по какой цене?
Полученный в результате очистки золотой слиток (королёк) чаще всего имеет незначительный вес. Однако даже в таком количестве он представляет интерес для скупщиков.

Зачастую цельный металл приобретают те же фирмы, что занимаются скупкой радиодеталей.
Золотом могут заинтересоваться и скупщики других металлов (например, алюминия или латуни).
Если покупатель находится в одном городе с продавцом, сделка совершается при визите по указанному адресу.
Скупщик сам взвешивает металл и проверяет его качество, после чего назначает цену. Разумеется, если есть возможность, желательно проверить все предложения на рынке, чтобы выбрать самое выгодное. В другой город слиток можно отправить по почте наложенным платежом.
Некоторые ломбарды также готовы принять товар такого рода. Чтобы выяснить, по какой цене заведение готово будет приобрести золото, обратитесь к работнику ломбарда. Другой вариант – самому подать объявление. В этом случае вам лишь придется ждать звонка от потенциального покупателя.
Если заниматься аффинажем в промышленных масштабах, то следует опираться на действующие законы.
Чтобы легально заниматься оборотом драгоценных металлов, нужно зарегистрироваться в качестве ИП или создать ООО.
При сбыте золота ориентируйтесь на его чистоту и на рыночную стоимость.
Цена за грамм драгметалла 999 пробы устанавливается Центробанком России. С 2004 года цены на него непрерывно растут. Самый значительный скачок наблюдался в 2016 году, когда стоимость превысила 3 тысячи рублей за грамм.
Видео по теме
В данном видео представлена пошаговая инструкция по добыче и извлечению золота из микросхем, процессоров и радиодеталей:
Вывод
Аффинаж золота и позолоты с радиодеталей – сложный и трудоемкий процесс, для которого необходимо наличие как достаточного количества исходного сырья, так и многочисленных химикатов и оборудования для электролиза.
Прочитав эту статью, вы узнали, что такое аффинаж золота, какими способами он проводится, и как извлечь чистый металл из радиодеталей и микросхем в домашних условиях.
Техническая азотная кислота
Получение азотной кислоты осуществляется тремя способами, которые мы опишем в том порядке, в каком они начали применяться в промышленности.
1.Получение азотной кислоты из селитры. Наиболее старый способ получения азотной кислоты, которым пользовались уже в середине XVII в., заключается в нагревании натриевой селитры с концентрированной серной кислотой: NaNО3 + H2SО4 = NaHSО4 + HNО3
Выделяющиеся при нагревании пары азотной кислоты направляются в охлаждаемый водой приемник, где они сгущаются в жидкость. При слабом нагревании и избытке серной кислоты реакция идет с образованием кислой соли. Если же взять достаточное количество селитры и нагревать сильнее, то получается нормальная соль:
Однако при этом происходит значительная потеря азотной кислоты вследствие ее разложения. Поэтому процесс ведут таким образом, чтобы реакция протекала по первому уравнению.
До начала текущего столетия описанный способ получения азотной кислоты был единственным применяемым в промышленности. Затем он был почти полностью вытеснен другими способами, основанными на фиксации атмосферного азота.
2. Получение азотной кислоты из воздуха дуговым методом. В основе этого метода, впервые технически осуществленного в Норвегии в 1905 г., лежит описанная в реакция непосредственного соединения азота с кислородом. Необходимая для этой реакции высокая температура получается при помощи электрической душ, питаемой мощным источником электрического тока. Если пламя электрической дуги поместить между двумя полюсами сильного электромагнита (рис. 98), то оно принимает форму плоского диска, вследствие чего поверхность пламени сильно увеличивается. Этот огненный диск, достигающий 3 м в диаметре, образуется в сложенной из огнеупорных кирпичей специальной печи, температура в которой достигает 3000—3500°. Стенки печи пронизаны каналами, через которые в печь вдувается воздух. Приходя в соприкосновение с пламенем электрической дуги, воздух сильно нагревается, и в нем образуется некоторое количество окиси азота.
Выходящие из печи газы, содержащие 2—3% окиси азота, быстро охлаждают до 1000—1100°, чтобы образовавшаяся окись азота не могла разложиться обратно на азот и кислород. В процессе дальнейшего охлаждения газовой смеси окись азота присоединяет кислород, переходя в двуокись азота, которая поглощается водой и превращается в азотную кислоту.
Получение азотной кислоты описанным методом связано с затратой большого количества электрической энергии. Наибольшее развитие этот метод получил в Норвегии, располагающей значи-тельными ресурсами дешевой электроэнергии. К 1925 г. мировое производство азотных соединений, получаемых по дуговому методу, достигло 42 000 т в год в пересчете на азот. Однако в последнее время дуговой метод применяется в сравнительно небольших масштабах, так как оказалось экономически выгоднее получать азотную кислоту новым методом — окислением синтетического аммиака.
Окись азота легко переходит в двуокись азота, которая с водой образует азотную кислоту.
Возможность каталитического окисления аммиака в азотную кислоту была известна давно, но только в начале XX в. удалось использовать этот процесс для заводского получения азотной кислоты. В первых аппаратах для окисления аммиака катализатором служила платина. В настоящее время применяют преимущественно сплав платины с родием, содержащий 5—10% родия. Выход окиси азота составляет 96—98%.
На рис. 99 представлена схема заводской установки для окисления аммиака при атмосферном давлении. Освобожденный фильтрованием от механических примесей воздух подается вентилятором 1 в теплообменник 2, где он нагревается выходящими из контактного аппарата газами примерно до 300°, и затем поступает в смеситель 3. Сюда же вентилятором 4 подается газообразный аммиак. Из смесителя аммиачно-воздушная смесь, содержащая 10—11% аммиака, поступает в контактный аппарат 5, состоящий из двух полых конусов, соединенных основаниями. В широкой части аппарата закреплены горизонтально несколько сеток из тонких платино-родиевых нитей, служащих катализатором. В контактном аппарате происходит окисление аммиака в окись азота.
Выходящая из кон тактного аппарата горячая газовая смесь направляется в теплообменник. Здесь горячие газы охлаждаются до 500—550°, после чего их пропускают последовательно через паровой котел (для использования тепла), особые холодильники и, наконец, поглотительные башни, где в основном и происходит окисление окиси азота в двуокись и образование азотной кислоты.
Получаемая из башен кислота обычно содержит 50—55% HNО3. Превращение ее в более концентрированную кислоту достигается путем перегонки с серной кислотой, которая служит удерживающим воду средством. Кроме того, в последнее время разработан способ получения концентрированной азотной кислоты взаимодействием жидкой двуокиси азота с водой (или с разбавленной азотной кислотой) в присутствии кислорода под давлением 50 ат при температуре 75°. Реакция протекает по суммарному уравнению
По этому способу, называемому «прямым синтезом», получают сразу 98%-ную азотную кислоту.
В настоящее время большая часть азотной кислоты, вырабатываемой в огромных количествах, получается окислением аммиака. А так как главная масса аммиака получается путем синтеза из элементов, то в конечном счете этот способ, как и предыдущий, основан на фиксации атмосферного азота.
Основоположником отечественного производства синтетической азотной кислоты был инженер И. И. Андреев, который в 1914 г. впервые поставил вопрос об организации в России производства азотной кислоты окислением аммиака, образующегося при коксовании угля. Андреев тщательно изучил реакцию окисления аммиака на изготовленных под его руководством ката лизаторах и построил опытную промышленную установку. Полученные на этой установке экспериментальные данные были использованы при составлении проекта первого завода синтетической азотной кислоты, который был построен в Юзовке (ныне Сталино, Донецк) и пущен в ход в июле 1917 г. Опыт работы этого завода был широко использован советскими инженерами при проектировании новых заводов, построенных в годы первых пятилеток.
Вы читаете, статья на тему Техническая азотная кислота
Алгоритм и необходимые вещества для осаждения золота
Процесс аффинажа золота, то есть его очищения, проходит в несколько этапов: растворение, фильтрование и осаждение золота. И если вы прошли два начальных этапа очистки драгметалла, у вас наверняка возникнет вопрос, чем осадить золото.
Золотой предмет боле низкой пробы растворяется в царской водке, а далее выпаривается и фильтруется. Процесс достаточно трудоемкий, но многие проводят его дома. Но поскольку это небезопасно, не забывайте о правилах техники безопасности.
И поскольку на выходе двух этапов золото находится в растворенном виде, чтоб извлечь его из раствора, необходимо его осадить. С точки зрения химии, этот процесс называется восстановлением. Поэтому для него нужно использовать вещества, которые имеют восстановительную способность.

Осаждение золота
Вещества для осаждения золота
Осаждение золота можно проводить с помощью таких реактивов, как:

Железный купорос
Есть еще много довольно интересных методов для осаждения, они замечательно подойдут для экспериментов. Например, используют винную кислоту, после которой золото выпадает черным осадком. А также осаждают золото сероводородом, оксалатами щелочных металлов. С помощью хлорида сурьмы происходит осаждение золота из его хлорида.
Сульфит натрия в этом процессе также распространенный компонент. Но этот способ восстановления не подойдет для осаждения золота из царской водки, только из его хлорида.
Осаждение и его суть
Осаждение золота железным купоросом проводится тогда, когда драгметалл представляет собой смесь царской водки и благородного элемента. Цвет жидкости может быть различным, химики отмечают, что растворенный в царской водке металл может мутнеть. Но по этому поводу беспокоиться не стоит.
Железный купорос — это всего лишь один из элементов, которые могут использоваться при осаждении. Но в большинстве случаев применяют именно его в силу доступности. По своей сути сульфат железа — это порошок, который имеет желтый или зеленоватый оттенок и используется химиками и медиками, поскольку является еще и лекарственным средством.
Осаждение — это выделение Au из раствора; если процедуру проводить с использованием сульфата железа, то стоит соблюдать определенную последовательность:
Но осаждение золота на этом не заканчивается. Необходимо собрать осадок, его промыть под потоком воды и высушить, используя бумажный фильтр. Когда частицы высохнут, фильтр сжигают или выбрасывают, а порошок, который был получен в процессе аффинажа, — это и есть золото, ранее растворенное в царской водке. Количество примесей в составе драгметалла не слишком велико, зачастую удается получить золото высокой пробы.
Осаждение на этом можно считать завершенным. Но полученные частицы Au необходимо переплавить в слиток или небольшой кусочек.
Но осаждение проводят не только с использованием железного купороса, можно использовать и другие вещества.
Что не стоит использовать в процессе?
Есть также вещества, с которыми нет смысла проводить эксперименты, потому что они или не дадут абсолютно никакой реакции, или усугубят процесс восстановления. В этот перечень входят:
И хотя в результате всех действий можно получить золото 999 пробы. Восстановление металла — трудоемкий процесс, который не покорится с первого раза новичкам. Важно соблюдать все сроки и пропорции. Поэтому при его выполнении следует обязательно заботиться о собственной безопасности, поскольку цена эксперимента может оказаться действительно высокой.
MariNA&RuS — химические опыты поиск монет рыбалка:
Золото зависло в растворе. Грязный раствор, что делать? Последнее время очень много пишут, что золото зависло в растворе и ни чего не могут сделать. В обзоре показываем один из методов,как и что можно сделать. Метод не идеальный, но для новичков самое то. Смотрим внимательно и берем на заметку.
Шестисотый лайк мой))
Дайте пожалуйста ссылку на группу в ВК)
подскажите, пожалуйста. начал гасить азотку сульфаминовой кислотой — раствор стал рыжеть и сильно пениться. несколько раз упаривал. сыплю сульфаминку опять та же реакция. психанул) налил 5мл хлорного олова и после нагрева раствор снова стал чёрным однородным. опять сульфаминка и опять рыжая муть, пена….
А куда делась тогда оловянная кислота? Как это не было мути при первой фильтрации??
Доброго времени суток! Помогите пожалуйста разобраться! Я сразу растворил разный материал в царе, после фильтрации в растворе выпала коричневая муть, от которой я избавился с помощью подливания электролита и подогрева. От мути я избавился, погасил азотку мочевиной и добавил в раствор железный купарос(развёл в воде). Ничего не выпало.
Ребята, не пинайте. Произошло все случайно.сыпанул сульфит натрия…потом вспомнил, что не заморачивался гашением азотки. Ну и остановил это занятие… Понимаете да…ну думаю…прилью купорос.. Ну так …бинго. Алилуя! Выпали почти мгновенно две увесистые какахи…)не призываю повторять… Просто что было.. То было
Подскажите пожалуйста… Не знаю что делать( растворил золотые часы ещё несколько мелочей в царе, выпарил насухо, разбавил это всё водой, осаждал жел. купоросом магазинным, грел, оседает только белая муть, золото не выпадает, что делать. Уже пачку купороса истратил, не могу ни с одного раствора ничего достать, уже раза по два пробовал каждый раствор осаждать….
Приветствую. Все понятно, но у меня нет возможности раздобыть гидрохинон и я применил купорос, чистый не магазинный и металл в растворе завис((.
Ребята, это супер, что у вас хобби общие.) а на кухне вместе колдуете?
Здравствуйте! Подскажите пожалуйста, растворил позолоту цв, погасил азотки мочевиной, при осаждении жел.купоросом, примерно половина золота осталась в растворе. Как выяснил? Во первых мало осело. Добавил соды до ph10, выпал осадок темный со ржавчиной. растворил его цв, причем растворился сперва темный, а мелкодисперсный рыжий нет, и только потом при небольшом нагреве растворилась эта рыжая муть. Как такое могло произойти и что теперь делать? спасибо
Добрый день…. Можете подсказать что мне делать…. Был раствор с золотом(царская водка с золотом), хотел осаждать гидрзином, но получилос тёмно синий раствор, что делать.
Подскажите, обязательно ли гасить азотную кислоту, если осаждать гидразином? И я так понимаю, что гасите сульфаминовой кислотой, где можно про это посмотреть или почитать?
Здравствуйте! можете ли продать реагенты для восстановления золота?колхозными реагентами запороли много раствора.89609008633 Сергей.
хороший наглядный пример. спасибо
Добрый день дорогие друзья. Подскажите пожалуйста, где можно купить сульфаминку?? У меня проблема, не могу избавиться от Азотки, что делать?))) заранее спасибо!
Химический метод
Химический метод извлечения золота из радиодеталей является самым распространённым. Всё, что нужно для его осуществления – азотная кислота. Дело в том, что эта кислота растворяет практически все металлы кроме золота. По завершению процесса нужно будет лишь собрать образовавшуюся золотую фольгу.
В конце реакции можно будет наблюдать выделение из кислоты пара. Это говорит о том, что азотная кислота ещё не утеряла свои свойства. Ёмкость, куда будет заливаться азотная кислота, должна быть изготовлена из алюминия, так как он тоже не вступает в реакцию с азотной кислотой. Чтобы ускорить процесс добычи золота, кислоту можно подогреть. Но нужно знать, что её ни в коем случае нельзя нагревать выше 60 градусов.
Скорость протекания реакции зависит и от количества кислоты. Рекомендуется, чтобы объём кислоты был в 3 или более раза больше объёма очищаемых радиодеталей. Также желательно чтобы кастрюля, в которой будет проходить весь процесс, была с высокими бортами, так как при протекании реакции будут образовываться пузыри. В процессе реакции кислота будет распадаться на нитраты, что увеличит её в объёме – это тоже нужно брать во внимание.
Перед тем как добавить в кислоту радиодеталь, покрытую золотом, её нужно подготовить. А именно нужно удалить с её по возможности все лишние элементы, оставив только часть с золотом. Если этого не сделать, то эффективность раствора снизится и его придётся периодически менять на новый.
К химическому способу можно отнести и извлечение золота при помощи «царской водки». Делается такой раствор из азотной и соляной кислот, при смешивании которых получается сильный растворитель, способный растворить любой металл. В конце реакции в ёмкость добавляется гидразин, без которого обнаружить золотые частицы не удастся. После добавления гидразина образуется коричневая масса, которая и представляет собой золото. Однако такое золото имеет очень низкую пробу. Чтобы получить золото более высокой пробы, процесс травли необходимо повторить ещё 3-4 раза.
Электролиз
Данный метод извлечения золота из радиодеталей рекомендуется применять в том случае, если золото нанесено на деталь из меди или из её сплавов, то можно воспользоваться электролизом. Для этого золотосодержащие радиодетали помещаются в раствор из серной или соляной кислоты. Плотность тока при этом должна быть в пределах 0,1-1 А/дм2. Когда сила тока начнёт падать, реакцию можно будет считать завершённой.
Иногда золото, добытое из радиодеталей, оказывается не жёлтого, а белого или зелёного цвета. Волноваться не стоит. Это происходит потому, что золото содержит в себе примеси. Например, если в золоте содержится 5% палладия, оно будет белым, а если 30% серебра – зелёным. Если же извлекать золото самому не хочется, то можно обратиться в организации, которые этим занимаются. В Москве сдать радиодетали очень просто, так как сегодня огромное количество сервисов предлагают данную услугу.
◄ Назад к новостям
Что такое царская водка?
Растворение золота — процесс сложный и трудоемкий, по этой причине алхимики на протяжении нескольких веков пытались найти универсальный растворитель. Он был необходим им не только для опознания металла, но и для превращения железа в золото.
Растворение золота в царской водке
Первые описания царской водки появились еще задолго до того, как была открыта соляная кислота. Путем проб и ошибок Псевдо-Гебером была получена смесь, которая, по его мнению, могла растворить любой металл, в том числе и золото. Случилось это в Европе. Реакция проходила с использованием следующих компонентов:
Процесс получения растворителя проходил методом сухой перегонки. Алхимик рекомендовал готовить смесь в посуде из стекла, которая была плотно запаяна.
Вторичной водкой смесь азотной и соляной кислоты называл ученый Альберт Великий. Первичной водкой он считал азотную кислоту.
Бонавентура, третий исследователь, описал смесь кислот как растворитель, он изложил на бумаге свои опыты, а раствор, который смог получить, назвал «крепкой водкой».
Ученные из Царской России также питали интерес к химии, одним из первых, кто описал в своих работах смесь соляной и азотной кислот, стал Михаил Ломоносов. Примечателен и тот факт, что изначально слово «водка» не имело никакой связи с крепкими спиртными напитками. Она происходила от слова вода, только в форме уменьшительно-ласкательной. В воде золото не растворяется — это известно всем, но вот смесь кислот обладает прозрачностью, которая свойственна воде, по этой причине ее и назвали водкой.
Когда золото начинает растворяться или раствор взаимодействует с воздухом, то реакция проходит с выделением газа. Ранее считалось, что это пары драгоценного металла, которые испаряются во время реакции, но с годами стало известно, что газ, который выделяется в период растворения золота, — это хлор.
Свойства царской водки:
Золото растворяется в растворе при комнатной температуре, но если есть необходимость ускорить реакцию, то смесь кислот нагревают.
Можно отметить и еще несколько свойств царской водки:
Описывая свойства царской водки, можно вспомнить один интересный факт, когда немецким ученым удалось сохранить свои награды.
Получение Нобелевской премии в Германии в период правления Адольфа Гитлера было запрещено. По причине того, что как-то раз награду получил немецкий химик и противник национал-социалистической партии Карл фон Осецкий.
Два физика из Германии, опасаясь конфискации, передали свои награды химику Дьёрдью де Хевеши. Он спрятал медали, но когда немцы оккупировали Копенгаген, химик испугался того, что награды будут изъяты. Он растворил медали в царской водке и поставил банку на полку. Обыскивая помещение, немецкие военные не обратили внимания на раствор.
После окончания войны химик восстановил золото и отправил его вместе с письмом Шведской королевской академии, произошло это спустя три года. Нобелевский фонд изготовил из золота новые медали и вернул их владельцам.
Химический состав электролита для аккумулятора и способы его приготовления
Электролит является химическим раствором, и состоит из серной кислоты и дистиллированной воды. Состав способствует протеканию химических реакций между положительно и отрицательно заряженными свинцовыми пластинами в аккумуляторной батарее. При нормальных условиях эксплуатации АКБ требуется проводить только контроль уровня электролита и оценивать его плотность (около 1,27 г/см3).
В случае отдельных сбоев – понижение уровня, выкипание, несвоевременное обслуживание возможно изменение уровня и состояния химического раствора. Это значительно снижает срок эффективного использования АКБ, приводит к возникновению нештатных ситуаций.
Что из себя представляет электролит и зачем его использовать
Это жидкость на основе кислоты или щелочи. Работает она как проводник тока. При повышении уровня заряда АКБ плотность жидкости повышается.
Химический раствор должен быть качественным, сделанным без отступлений от технологии изготовления. В противном случае заряд аккумулятора не произойдет.







Присадки
Рынок предлагает огромное количество различных добавок, которые заливают в батарею для повышения качества электролита. Производители обещают улучшение запуска в морозы, увеличение срока службы, восстановление работоспособности АКБ и повышение энергоёмкости. Основное их действие — это десульфатация, но не настолько сильная, как заверяет реклама. Остальное не имеет достаточного подтверждения. Состав присадок редко раскрывают. Чаще всего это сульфаты или фосфаты металлов. Встречаются и средства из органических соединений. Причём вторые добавляют к аккумуляторной жидкости вместе с первыми. Для поддержания наилучшего состояния АКБ достаточно убирать его в период сильного похолодания в тёплое помещение или подзаряжать. Но это подойдёт, если говорить о регионах с умеренным климатом. Когда речь идёт о работе в экстремальных температурах, выгоднее может оказаться приобретение сухозаряженной батареи. Владелец сможет самостоятельно заливать электролит, максимально подходящий к условиям эксплуатации. На видео ниже показано, как из электролита получить серную и соляную кислоты.
Какие виды химической жидкости существуют
Поскольку электролит – это смесь либо на основе кислоты либо щелочи, то видов этой смеси два: щелочная и кислотная.
Кислотная – симбиоз кислоты и дистиллированной воды. Аккумуляторы с этим типом электролита нужны, чтобы запустить двигатель.
В щелочном типе жидкости применяется смесь кальциево-литиевой основы и дистиллированной воды.
Способ приготовления кислотного раствора
Готовим щелочной раствор
Нам понадобится посуда, устойчивая к химическим щелочным реакциям, щелочь (едкий калий или едкий натрий), можно добавлять литиевые вещества для улучшения качества раствора, вода.
Важно! Воду добавляем полностью очищенную, т.е. дистиллированную!
Электролит с повышенной плотностью
Он может понадобиться нам для коррекции плотности находящегося в аккумуляторе. В случае если вы добавили в банки батареи много воды и плотность химической смеси упала, можно откорректировать ее с помощью электролита с большей плотностью.
Для приготовления немного меняем пропорции щелочи (кислоты) и воды (0,423 к-ты на 0,650 воды). Очередность действий такая же, как и при изготовлении основного раствора.
Химические свойства электролита такие же, но температура замерзания ниже. Смесь используется только для корректировки основного электролита.



Серная кислота в аккумуляторе
По сути то, что залито в аккумулятор — это разбавленная серная кислота. В основе работы любого свинцово-кислотного аккумулятора лежит химический процесс, высвобождающий электрический заряд. Молекулы серной кислоты расщепляют посредством электролитической диссоциации свинцовые электроды, создавая положительно и отрицательно заряженные ионы.
Собираясь на положительных и отрицательных электродах батареи, ионы создают на клеммах АКБ необходимый заряд. Со временем часть молекул связывается без возможности возобновить свою работу в банках, что снижает плотность электролита. Поэтому так важно следить за концентрацией аккумуляторной кислоты.
Процесс носит название электролитической диссоциации. При нём ионы с положительным зарядом(катионы) — устремляются к плюсовому электроду. К отрицательному электроду направляются анионы — отрицательно заряженные ионы.
Окислителем выступает диоксид свинца, который в результате взаимодействия с молекулами кислоты восстанавливается, отдавая отрицательный заряд на электроды. Растворы серной кислоты слабо проводят электрический ток, однако хорошо справляется с ионным обменом.
При разрядке АКБ положительные ионы свинца устремляются через электролит с губчатого свинца – восстановителя. Здесь происходит превращение в двухвалентный свинец из четырехвалентного, таким образом, оставляя заряд 2 электронов с каждого иона.
Во время зарядки идут обратные реакции — свинец движется в сторону пластин.
Оба электрода покрываются слоем сульфата, который образовывается из отрицательных кислотных остатков и положительных двухвалентных ионов свинца. Это называется сульфатацией, которая для пластин аккумулятора весьма опасна и грозит быстрым износом. Выделяемые газы в процессе восстановительно-окислительных реакций считаются побочным эффектом, однако они могут серьёзно повлиять на работоспособность всей батареи.
В процессе разрядки батареи к отрицательно заряженному электроду устремляются электроны, где они производят нейтрализацию ионов свинца. В зависимости от уровня заряда батареи плотность электролита может иметь разное значение.
Измерения делаются при комнатной температуре + 25 °С. Использование кислоты происходит в 1,6 раз больше положительными электродами. Поэтому рост объема электролита наблюдается при разрядке батареи и уменьшение – при зарядке.
Это интересно: Плюсы и минусы солнечных батарей из аморфного кремния
Для каких аккумуляторов используют разные типы химической жидкости?
Чтобы не ошибиться, следует изучить этикетку на аккумуляторе. Если батарея свинцово-кислотного типа, то используем кислотную смесь.
В щелочные батареи наливаем раствор на основе калиевого или натриевого вещества. Тип щелочи можно узнать по горению. Калий горит фиолетово-красным, а натрий — желтым огнем.
Итак, если вдруг возникнет необходимость самостоятельно приготовить электролит для аккумулятора, то, в принципе, это возможно. Следует соблюдать технику безопасности и быть внимательным к пропорциям веществ — и все обязательно получится.
Как сделать смесь своими руками
Теперь к вопросу о том, как приготовить самостоятельно электролит для своего аккумулятора.
Здесь нет ничего сложного. В основном акцент делают на технике безопасности и постепенном добавлении кислоты. Не стоит сразу всю порцию заливать в дистиллят. Думайте о собственной безопасности.
Нюансы приготовления электролитов для свинцовых типов аккумуляторов не сильно отличаются от щелочных. Но будет правильно рассмотреть их отдельно.
Кислотные АКБ
Работать нужно только в проветриваемых помещениях, где температура не превышает 25 градусов Цельсия. Прежде чем готовить смесь, определите объём жидкости, помещающейся в вашу батарею. Это около 2,5-3,8 литров для АКБ под легковые автомобили.
Электролит лучше приготовить с небольшим запасом. Буквально 300 мл.
Ориентируйтесь на климатическую обстановку. Чем температура ниже, тем более плотный электролит потребуется залить.
Теперь пошагово о том, как правильно и самостоятельно приготовить нужный электролит для заливки внутрь своего аккумулятора:
Затем нужно дистиллированной водой промыть аккумулятор, чтобы вывести оттуда остатки старой жидкости.
Заливается свежая смесь и АКБ ставится на зарядку. По завершении зарядки проводится контрольный замер плотности. При необходимости состав корректируется кислотой или водой.
Даже если при смешивании получились нужные характеристики, это не означает, что после зарядки они останутся такими же.
Щелочные АКБ
Далее к вопросу приготовления электролита, но уже на щелочной основе.
Тут принимают во внимание текущее агрегатное состояние основного компонента. То есть щелочи. В основном это гранулы, либо жидкость. В жидком состоянии щёлочь смешивают с водой.
Если используются гранулы, тогда их следует засыпать в дистиллированную воду и перемешать палочкой из стекла. Пропорции прописаны в заводской инструкции АКБ. Поэтому стоит взглянуть на боковую часть батареи. Там должна быть наклейка.
Плотность также зависит от условий климата. При низкой температуре воздуха используется более плотная рабочая жидкость.
Есть несколько наиболее часто используемых пропорций:
После смешивания полученный состав следует оставить в течение 6 часов, герметично закрыв крышкой. Если будет контакт с воздухом, это приведёт к деградации смеси, и её свойства ухудшатся.
За время выдержки часть щелочей выпадает в осадок. Заливать внутрь аккумулятора необходимо только светлую жидкость, без осадка.
Если внутрь батареи попадут твёрдые фракции, это приведёт к замыканию электродов, и быстрому выходу из строя аккумулятора.
Как сделать электролит

Сейчас в продаже возможно приобретение электролита для любых разновидностей аккумуляторов, но иногда возникает необходимость в его самостоятельном изготовлении. Приготовить электролит для аккумулятора несложно при выполнении ряда условий.
Состав электролита
Электролит является раствором активного вещества в дистиллированной воде. В зависимости от типа используемых аккумуляторных батарей активным веществом являются:
В щелочных АКБ для выполнения особых требований в составе электролита может присутствовать добавка едкого лития. Также едкий литий является основным в литий-ионных и литий-полимерных аккумуляторах.
Требования к компонентам
Нормальное протекание химических реакций предъявляет особые требования к веществам электролита. Основное требование – высокая степень чистоты материалов. Чем чище будут химические вещества для приготовления электролита, тем выше будет КПД аккумуляторов и их долговечность.
Согласно требованиям стандартов, аккумуляторная серная кислота должна содержать не менее 92 – 94% серной кислоты. Оставшиеся 6 – 8% занимает вода. Содержание солей металлов не более тысячных долей процента.
Внимание! Щелочь выпускается в сухом виде и к ней предъявляются подобные требования.
Если с перечисленными веществами вопросов обычно не возникает (ответственность за чистоту возлагается на предприятия, выпускающие материалы и торговые организации), то с водой дела обстоят несколько хуже. Многие автолюбители не делают различие между обычной и дистиллированной водой.
Вода из водопровода насыщенна растворами различных солей металлов и органических веществ. Простое кипячение в состоянии избавиться от незначительного количества солей жесткости, а остальные вещества остаются в неизменном виде. В водопроводной воде наиболее опасными для аккумуляторов являются соли железа, находящиеся там в больших концентрациях.
Активные вещества для электролита нужно разводить дистиллированной водой, которая отличается тем, что содержание солей в ней минимально. Такая вода по своим химическим и физическим параметрам практически соответствует идеальной.
Плотность электролита
Количество исходных веществ
Чтобы приготовить электролит с заданным значением плотности, нужно взять строго определенное количество исходных веществ. В таблице ниже приведены данные по наиболее распространенным значениям плотности для разных типов электролита.
Для повышения допустимой температуры эксплуатации в регионах с жарким климатом или на предприятиях с высокой температурой окружающего воздуха, в щелочные аккумуляторы вводится добавка едкого лития в количестве 15-20 гр. на литр электролита.
Особенности технологии приготовления электролита
При самостоятельном приготовлении следует помнить следующее:
Из перечисленного следует, что посуда для приготовления электролита должна быть из материала, стойкого к действию агрессивных веществ и температуры. Наиболее соответствует этим требованиям посуда из стекла и керамики. Использование пластиковой посуды возможно при условии недопускания ее нагрева до высоких температур. Нельзя использовать эмалированную посуду, поскольку при наличии незаметных трещин в эмали будет происходить загрязнение электролита солями металлов. То же самое относится к изделиям из нержавеющей стали. Такие материалы не вступают в реакцию с водой, но производители не гарантируют ее нейтральность по отношению к агрессивным веществам.
Важно! Перед тем, как сделать электролит, заранее отмеряют необходимое количество компонентов.
Приготовление кислотного электролита
Высокая плотность кислоты и способность разогрева при смешивании с водой обусловили специфику приготовления раствора: кислоту нужно вливать в воду. Если поступить наоборот, то вода, оказавшись сверху, нагреется до температуры закипания и выплеснется наружу вместе с каплями кислоты.
Чтобы уменьшить нагрев, кислоту целесообразно разбавить в два этапа. На первом готовится раствор плотностью 1.40, а затем, после остывания, делают электролит необходимой концентрации. Раствор с плотностью 1.40 называют корректирующим. Он применяется для коррекции плотности электролита в рабочих аккумуляторах. После добавления кислоты в воду смесь аккуратно перемешивают стеклянной палочкой. Приготовленный электролит необходимо оставить на некоторое время (от половины до суток) для его равномерного смешивания и полного остывания.
Внимание! Срок хранения кислотного раствора неограничен.
Приготовление щелочного электролита
Необходимое количество щелочи высыпают в отмеренное количество воды и перемешивают до полного растворения. Также необходимо выдержать время, пока осадок не растворится полностью и температура не опустится до нормальной.
Раствор щелочи нужно хранить в герметично закрытой таре, не допуская попадания воздуха. Углекислый газ легко вступает в реакцию со щелочами с образованием карбонатов – солей угольной кислоты. В результате содержание активного вещества в растворе с течением времени падает.
Растворы кислоты и щелочи должны быть прозрачными или иметь легкий желтоватый оттенок. Наличие мутности отстоявшегося раствора говорит о низкой чистоте исходных компонентов и для использования в аккумуляторах непригодны.
Меры безопасности
Приготовление электролита представляет собой опасность из-за использования очень агрессивных веществ. Концентрированные растворы кислоты и щелочей способны вызвать труднозаживающие кислотные ожоги, а при попадании в глаза вызывают слепоту.
Перед работой следует приготовить нейтрализующий раствор для смывки случайно попавших на тело капель электролита:
Работать следует в резиновых перчатках и обязательно в защитных очках или маске. При попадании электролита на кожу нужно обильно промыть место попадания нейтрализующим раствором, а после промывки глаз немедленно обратиться к врачу.
Все работы производятся на открытом воздухе или хорошо вентилируемом помещении. Пары кислоты, выделяющиеся при приготовлении раствора (особенно в горячем состоянии) вызывают раздражение верхних дыхательных путей, выраженные сильным кашлем и отеком слизистых оболочек.
В качестве одежды в домашних условиях можно использовать ту, которую не сильно жалко, поскольку даже после промывки нейтрализующим раствором между волокнами ткани останется часть агрессивного вещества и вещи будут безнадежно испорчены.
Что такое аккумуляторный электролит и как его приготовить своими руками
Основная масса автомобилей работают совместно с кислотными аккумуляторами. Но встречаются и щелочные устройства. Они используются в различных сферах.
В аккумуляторы на производстве заливается специальная жидкость. В её основе лежит кислота или щёлочь. Этот состав рассчитан на весь эксплуатационный период. Если батарея относится к обслуживаемому типу, тогда периодически автовладелец доливает туда небольшое количество воды по мере её испарения.
Если раствор замёрз или помутнел, но сами пластины остались целыми и пригодными к эксплуатации, можно заменить электролит. В большинстве случаев приобретают готовые растворы с нужной плотностью. Но есть и те, кто предпочитает делать их своими руками.
Состав рабочей жидкости
В составе электролита для автомобильных аккумуляторов присутствует несколько компонентов.
Он зависит от типа самой АКБ. Многим будет интересно узнать о том, из чего же состоит электролит, и какая жидкость находится внутри корпуса аккумулятора.
Это даёт понять, из чего состоит используемый в конструкции аккумулятора жидкий электролит.
Существуют АКБ с гелевым наполнением. Это тот же электролит, но смешанный со специальными загустителями. Подобные батареи необслуживаемые. А потому приготовить гель и залить его никак не получится.
Такой состав для АКБ остаётся неизменным. Всегда рекомендуется заливать такой же электролит, который был использован производителем. Это связано ещё и с составом свинцовых пластин, где также применяются разные добавки для улучшения их характеристик.
Основной упор с позиции автомобилистов делают на электролит для кислотных аккумуляторов и их состав. Ведь именно такие АКБ применяются для запуска двигателя и питания других потребителей в машине.
Компоненты и плотность
Чтобы химические реакции внутри протекали правильно и эффективно, нужно знать, какой именно электролит следует заливать в аккумулятор.
Для таких целей используются электролитические жидкости без посторонних примесей. В противном случае они могут начать активно снижать ёмкость батареи, либо вообще не позволят источнику питания работать.
Чтобы поднять эффективность и работоспособность, используйте чистые компоненты. По регламенту при заправке свинцовых автомобильных аккумуляторов в составе серной кислоты должно быть не более 7-8% воды.
Покупая готовый электролит, нужно смотреть на его состав и такие свойства как плотность. Для аккумуляторов это важнейший показатель. Причём плотность заливаемой электролитической жидкости зависит от региона и температурных условий, в которых эксплуатируется АКБ вместе с автомобилем.
Тут требования такие:
Если говорить о щелочах, то эти компоненты поставляются в виде сухого состава. Важно, чтобы при транспортировке или во время хранения сухая щёлочь не вступала в реакцию с другими реагентами.
Гранулы нужно засыпать в дистиллированную воду, после чего перемешать. При необходимости в состав добавляют присадки.
Требования безопасности при самостоятельном приготовлении
Если вы решили сделать электролит для заправки своей свинцовой аккумуляторной батареи в домашних условиях, то крайне важно соблюдать технику безопасности.
Согласно этим правилам, состав приготовляется при выполнении следующих условий:
Соблюдение таких требований и правил убережёт вас от ошибок, сохранит здоровье, а также позволит успешно перезалить аккумуляторную батарею.
Что необходимо для работы
Для приготовления электролитической смеси рекомендуется заранее всё подготовить.
В список основного оборудования и приспособлений входят:
Если всё это есть, то можно приступать к работе.
Как сделать смесь своими руками
Теперь к вопросу о том, как приготовить самостоятельно электролит для своего аккумулятора.
Здесь нет ничего сложного. В основном акцент делают на технике безопасности и постепенном добавлении кислоты. Не стоит сразу всю порцию заливать в дистиллят. Думайте о собственной безопасности.
Нюансы приготовления электролитов для свинцовых типов аккумуляторов не сильно отличаются от щелочных. Но будет правильно рассмотреть их отдельно.
Кислотные АКБ
Работать нужно только в проветриваемых помещениях, где температура не превышает 25 градусов Цельсия. Прежде чем готовить смесь, определите объём жидкости, помещающейся в вашу батарею. Это около 2,5-3,8 литров для АКБ под легковые автомобили.
Электролит лучше приготовить с небольшим запасом. Буквально 300 мл.
Ориентируйтесь на климатическую обстановку. Чем температура ниже, тем более плотный электролит потребуется залить.
Теперь пошагово о том, как правильно и самостоятельно приготовить нужный электролит для заливки внутрь своего аккумулятора:
Затем нужно дистиллированной водой промыть аккумулятор, чтобы вывести оттуда остатки старой жидкости.
Заливается свежая смесь и АКБ ставится на зарядку. По завершении зарядки проводится контрольный замер плотности. При необходимости состав корректируется кислотой или водой.
[important] Показатели плотности будут правильными лишь при условии, что АКБ полностью заряжена. [/important]
Даже если при смешивании получились нужные характеристики, это не означает, что после зарядки они останутся такими же.
Щелочные АКБ
Далее к вопросу приготовления электролита, но уже на щелочной основе.
Тут принимают во внимание текущее агрегатное состояние основного компонента. То есть щелочи. В основном это гранулы, либо жидкость. В жидком состоянии щёлочь смешивают с водой.
Если используются гранулы, тогда их следует засыпать в дистиллированную воду и перемешать палочкой из стекла. Пропорции прописаны в заводской инструкции АКБ. Поэтому стоит взглянуть на боковую часть батареи. Там должна быть наклейка.
Плотность также зависит от условий климата. При низкой температуре воздуха используется более плотная рабочая жидкость.
Есть несколько наиболее часто используемых пропорций:
После смешивания полученный состав следует оставить в течение 6 часов, герметично закрыв крышкой. Если будет контакт с воздухом, это приведёт к деградации смеси, и её свойства ухудшатся.
За время выдержки часть щелочей выпадает в осадок. Заливать внутрь аккумулятора необходимо только светлую жидкость, без осадка.
Если внутрь батареи попадут твёрдые фракции, это приведёт к замыканию электродов, и быстрому выходу из строя аккумулятора.
Какие ещё бывают электролиты
Если говорить о самостоятельном приготовлении электролита, проводимого в домашних условиях, то тут практикуется только жидкий щелочной и кислотный тип смеси. Причём первый делают намного чаще.
Остальные виды электролитических составов не готовят самостоятельно. Это касается гелевых и AGM аккумуляторов. Потому пытаться их перезалить своими силами не рекомендуется. Технологически это сложно. Плюс эти батареи относятся к числу необслуживаемых. Чтобы добраться до электролита, придётся нарушать герметичность корпуса. А это уже крайне опасная затея. Ничем хорошим для чрезмерно экономного автовладельца это не закончится.
В самостоятельном обслуживании аккумуляторных батарей, которые предусматривают наличие крышек с доступом к электролиту, нет ничего сложного. Тут главное — быть внимательным, осторожным и последовательным в своих действиях.
Рассчитать пропорции между водой и кислотой, либо щёлочью, легко. Можно ориентироваться на таблицы по ГОСТу, либо просто вооружиться калькулятором.
Вы когда-нибудь делали электролит своими руками? Почему отказались от идеи его покупки в готовом виде? Для какого аккумулятора готовили смесь? Каким получился результат?
Делитесь своим опытом и личными наблюдениями в комментариях.
Подписывайтесь, оставляйте отзывы и задавайте актуальные вопросы!
Как своими руками приготовить электролит для АКБ
Мощные аккумуляторные батареи, используемые на транспорте и в промышленности, в качестве электрохимического реагента используют кислотные или щелочные растворы. Как правило, залитая в АКБ жидкость рассчитана на весь срок эксплуатации источника питании. Но зачастую со временем электролит деградирует (теряет свои свойства) – из-за загрязнения или в результате замерзания при отрицательных температурах. Помутневший раствор меняют, но необязательно покупать готовую жидкость – её можно приготовить в домашних условиях. Эта не слишком сложная операция позволит вам сэкономить часть денежных средств.
Состав электролита для аккумуляторов
В наиболее распространённых свинцово-кислотных батареях в качестве электролита используется водный раствор серной кислоты, достаточно концентрированный.
В щелочных батареях основным активным веществом является антипод кислоты – щёлочь, в состав электролита для щелочных аккумуляторов входят едкий калий и та же дистиллированная вода.
Поскольку преобладающими в автопроме являются кислотные аккумуляторы, рассмотрим состав электролита этого типа более подробно.
Серная кислота представляет собой прозрачную жидкость маслянистой концентрации, которая гораздо тяжелее воды. Она хорошо в ней растворяется и не имеет характерного запаха. Процесс смешивания серной кислоты с водой сопровождается выделением тепловой энергии, поэтому рекомендуется выполнять эту операцию с особой тщательностью и аккуратностью.
Второй компонент – дистиллированная, то есть подвергшаяся глубокой очистке вода Использование речной, водопроводной, а тем более технической воды не допускается. Согласно ГОСТу 06709-72, возможно использование воды, полученной их конденсата паротурбинных силовых установок, при этом такая жидкость должна в обязательном порядке подвергаться лабораторным анализам на предмет контроля уровня добавок – того же железа (не более 0.0004%) и меди (максимум 0.005%).
Разобравшись, из чего состоит электролит кислотного аккумулятора, стоит упомянуть, как готовят дистиллированную воду в промышленных условиях, в аптеках, лабораториях. Для этих целей применяют приборы под названием электрические дистилляторы.
Существуют модели менее производительные (до 5 литров/час) и способные готовить до 10 литров жидкости. Промышленные дистилляторы оперируют сотнями литров/час.
В лабораториях дистиллят также подвергается анализу с целью контроля уровня сухих веществ, кальция, сульфатов, аммиака, хлоридов, солей аммония, тяжёлых металлов.
Проще всего приобретать дистиллированную воду в аптеках – полуторалитровая ёмкость обойдётся вам в 10–25 рублей.
Какой должна быть плотность электролита
Использовать металлические ёмкости для приготовления электролита нельзя (за исключением свинцовых), желательно, чтобы это была фаянсовая, эбонитовая или пластиковая посуда, пластик нужен тоже специальный. Категорически воспрещено использовать стеклянную тару – во время нагрева она может лопнуть.
А поскольку процедура разбавления воды серной кислотой сопровождается выделением большого количества тепла, для измерения плотности приходится учитывать эти температурные колебания. Для этого используются термометры с ценой деления в один градус, рассчитанные на диапазон 0–50 градусов. К этим измерительным приборам предъявляются такие же требования, как и к ареометрам – они не должны содержать металлических или деревянных частей.
В домашних условиях учитывать температурный фактор гораздо проще, дождавшись, пока после очередного этапа смешивания электролит не остынет до 20º С.
Напротив, понижение температуры на те же 10 градусов приведёт к уменьшению плотности на такую же величину.
Заливать готовый электролит в аккумулятор допустимо, если температура жидкости не превышает 25º С.
Техника безопасности
Поскольку при работе с электролитом мы имеем дело с агрессивными жидкостями, щелочами и кислотами, соблюдение соответствующих мер безопасности является обязательным. Поэтому перед началом приготовления электролита для аккумуляторной батареи следует запастись следующими средствами ИЗ:
Необходимое оборудование
А теперь перечислим, что нам потребуется для домашнего приготовления электролита:
Как самостоятельно приготовить электролит для аккумулятора
Если средства индивидуальной безопасности, измерительные приборы и материалы приготовлены, можно приступать к смешиванию компонентов. Готовую жидкость рекомендуется сразу залить в АКБ, в крайнем случае – отнести в гараж. Разумеется, первый вариант предпочтительнее, поскольку хранение батареи без электролита приводит к деградации и разрушению активной массы электродов.
Рассмотрим, как приготовить электролит для кислотно-свинцовых аккумуляторов
Помещение, в котором вы будете работать, должно быть вентилируемым, температура не должна превышать 25° С. Аккумуляторы, используемые в легковом транспорте – это 55–60-амперные батареи, в которые помещается до 3.7 литра электролита (при желании эту цифру можно уточнить на сайте производителя). Чтобы перестраховаться, изготавливаем жидкости на 300–400 мл больше требуемого. До начала приготовления раствора необходимо определиться с его плотностью. Выше мы указали допустимый диапазон, а конкретное значение зависит от климата региона, в котором вы проживаете. Если это юг, то значение должно быть близким к минимальному порогу, с продвижением на север начальная плотность должна расти.
Алгоритм приготовления раствора для свинцовых аккумуляторов в домашних условиях:
Окончательный замер производится на полностью заряженном аккумуляторе.
Процесс приготовления электролита на щелочной основе
Щелочной электролит может продаваться в виде готового раствора или в гранулах. Последние засыпаются в дистиллированную воду, и жидкость стеклянной палочкой размешивается до полного растворения щёлочи. В какой пропорции брать компоненты, обычно указывается на этикетке аккумулятора, наклеенной на его боковой грани.
Приведём распространённые рецепты приготовления щелочного электролита:
Чтобы правильно приготовить щелочной электролит, после смешивания его необходимо выдержать в течение 6–8 часов для полноценного перемешивания в закрытой крышкой ёмкости. Контакт с атмосферным воздухом нежелателен – он оказывает деградирующее воздействие на электролит. Незначительная часть щёлочи обычно не растворяется, выпадая в осадок. В аккумулятор следует заливать только прозрачную жидкость, без примесей, которые становятся причиной замыкания пластин и увеличения тока саморазряда.
Другие виды электролитов
Гелевые батареи и AGM аккумуляторы также используют электролит, но самостоятельно приготовить его или долить/поменять не получится. Так, в гелевых АКБ используется загущённый электролит, получить который в домашних условиях с необходимыми характеристиками вряд ли возможно. Восстановление плотности таких батарей производится только доливкой воды, которая после правильной зарядки (несколькими циклами с использованием малых токов) частично восстанавливает ёмкость батареи.
Самостоятельное приготовление электролита для АКБ
Аккумуляторные батареи заправляются жидкостью на базе щелочи или кислоты, рассчитанной на весь срок работы изделия. При деградации реагента (помутнении или замерзании) можно попытаться заменить раствор, что позволит продлить срок эксплуатации изделия. При этом необходимо знать, как приготовить электролит для аккумулятора в домашних условиях.
Состав электролита для АКБ
Состав электролита зависит от типа аккумулятора:
Требования к плотности и компонентам
Для нормального протекания химических реакций в аккумуляторе необходимо применять электролитический состав без посторонних примесей, способных снизить емкость АКБ. Для повышения эффективности работы источника тока необходимо использовать химически чистые компоненты. Согласно регламенту при приготовлении электролита для свинцовых аккумуляторов используется кислота, содержащая не более 8% воды. Раствор замешивают на основе дистиллированной воды, не содержащей солей, применение жидкости из водопровода категорически запрещено.
Щелочь поставляется в высушенном виде, в процессе хранения и транспортировки материал не должен сыреть и вступать во взаимодействие с другими реагентами. Гранулы загружаются в дистиллированную воду и размешиваются, затем в раствор вводятся дополнительные компоненты.
Качество электролита для многоразовых химических источников тока напрямую зависит от соблюдения пропорций компонентов в рабочей жидкости.
Безопасность при домашнем приготовлении
Перед тем как самостоятельно сделать электролит в домашних условиях, необходимо ознакомиться с правилами техники безопасности:
Необходимое оборудование
Перед началом приготовления сернокислотного раствора необходимо подготовить:
Инструкция по приготовлению
После подготовки материалов и защитной экипировки можно приступить к смешиванию компонентов. Процедура приготовления сернокислотного или щелочного электролита не отличается сложностью. Полученные реагенты не рекомендуется хранить в домашних условиях: жидкость заливается в банки аккумулятора, который необходимо зарядить. Хранение батареи в разряженном состоянии не допускается, поскольку происходит разрушение электродов и деградация активной массы.
Кислотный состав
Работы выполняются в проветриваемом помещении при температуре воздуха не более 25°С. Перед смешиванием компонентов следует выяснить объем жидкости, необходимый для заправки аккумулятора. Автомобильные батареи емкостью 50-60 А*ч имеют корпусы, вмещающие до 3,7 л электролита. Рекомендуется изготовить немного больше рабочей жидкости (на 200-300 мл). Также необходимо определиться с плотностью электролита, зависящей от климатической зоны. Чем ниже температура окружающей среды, тем выше должна быть стартовая плотность электролита.
Для получения раствора, рассчитанного на эксплуатацию в южных регионах, требуется 330 мл кислоты (расчетная плотность – 1,24 г/см³).
Краткий алгоритм приготовления раствора:
На щелочной основе
При приготовлении щелочного раствора необходимо учитывать агрегатное состояние щелочи, которая поставляется в виде гранул или в жидком состоянии (в смеси с водой). Твердый материал засыпается в воду (дистиллированную) и растворяется размешиванием смеси стеклянной палочкой. Соотношение компонентов раствора указывается на заводской этикетке, наклеенной на боковой части источника питания.
Распространенные пропорции сухой щелочи и воды:
Полученный реагент необходимо выдержать в помещении на протяжении 6 часов, емкость закрывается герметичной крышкой. При контакте с воздухом происходит деградация электролита, ухудшающая электрохимические свойства раствора. Часть щелочи выпадает в осадок, для заливки в банки батареи используется осветленная фракция (находится в верхней части резервуара) без примесей. Попадание твердых частиц в полость банок вызывает замыкание отрицательных и положительных электродов, приводящее к ускоренному саморазряду источника постоянного тока.
Другие виды электролитов
Приготовление других типов электролитов в бытовых условиях не практикуется. Если в батарее используется загущенная смесь кислоты и воды (технология AGM или гелевые аккумуляторы), то самостоятельно приготовить раствор с нужными параметрами не получится. Для восстановления подобных устройств необходимо заправить в банки воду, которая постепенно пропитает губчатые прокладки. Затем производится несколько циклов зарядки малыми токами, что позволяет восстановить емкость.
Источники информации:
- http://1olestnice.ru/voprosy-otvety/kak-polychit-azotnyu-kisloty/
- http://rcycle.net/metally/dragotsennye/affinazh/poluchenie-zolota-v-domashnih-usloviyah-iz-radiodetalej-i-mikroshem
- http://znaesh-kak.com/x/x/%D1%82%D0%B5%D1%85%D0%BD%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B0%D1%8F-%D0%B0%D0%B7%D0%BE%D1%82%D0%BD%D0%B0%D1%8F-%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0
- http://yantarzoloto.ru/dragmetally/rastvorenie-zolota-jodom.html
- http://avto-layn.ru/na-zametku/sernaya-kislota-elektrolit.html
- http://batteryzone.ru/accumulator/kak-sdelat-jelektrolit
- http://remam.ru/elektrik/kak-prigotovit-sostav-elektrolita-dlja-akkumuljatora.html
- http://akbvavto.ru/maintenance/kak-prigotovit-sostav-elektrolita-dlya-akkumulyatora.html
- http://autochainik.ru/prigotovlenie-elektrlita.html