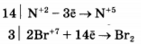хлорид ион имеет такую же электронную конфигурацию как ион
Вариант 10
Часть 1.
Ответом к заданиям 1–26 является последовательность цифр. Цифры в ответах на задания 5, 10–12, 18, 19, 22–26 могут повторяться.
Хлорид-ион имеет такую же электронную конфигурацию, как и:
Расположите в порядке уменьшения атомного радиуса химические элементы:
Такую же степень окисления, как и в сернистом газе, атом серы имеет в соединениях
Немолекулярное строение имеют:
3. уксусная кислота
Установите соответствие между формулой вещества и классом, к которому это вещество принадлежит: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
3) оксид несолеобразующий
4) оксид амфотерный
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует алюминий.
2. нитрат серебра (р-р)
4. гидроксид железа(II)
5. оксид углерода(II)
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует оксид фосфора(V).
1. гидроксид натрия
Сокращённому ионному уравнению
отвечает взаимодействие веществ:
1. карбоната железа и гидроксида калия
2. хлорида железа и гидроксида натрия
3. нитрата железа и гидроксида меди
4. нитрата железа и гидроксида бария
5. сульфата железа и гидроксида бария
Задана следующая схема превращений веществ:
[math]Fe\xrightarrow XFeCl_3\xrightarrow YFe(OH)_3[/math]
Определите, какие из указанных веществ являются веществами X и Y.
Установите соответствие между формулой вещества и степенью окисления азота в ней.
СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА
Установите соответствие между исходными веществами и основным продуктом их взаимодействия.
А) Аl(ОН)3 + RbOH (водн. р-р)
Б) Аl(ОН)3 + Rb2O
В) Аl(ОН)3 + CsOH
Г) Аl(ОН)3 + Cs2CO3
Установите соответствие между названием органического соединения и классом, к которому оно принадлежит.
3) предельные спирты
5) предельные карбоновые кислоты
6) ненасыщенные карбоновые кислоты
Циклопропан, в отличие от пропана, реагирует с
Этаналь, в отличие от этанола, реагирует с
3. гидроксидом меди(II)
5. гидроксидом железа(III)
Из предложенного перечня выберите два вещества, с которыми реагируют и глицин, и этиламин.
3. фосфорная кислота
5. оксид углерода(II)
В заданной схеме превращений
[math]CH_3COOH\xrightarrow XCICH_2COOH\xrightarrow YNH_2CH_2COOH[/math]
веществами X и Y соответственно являются:
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
А) хлорэтан и натрий
Б) хлорэтан и КОН(спирт.)
Г) бутен-2 и водород
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
А) 2-хлорбутан и KOH(спиртов.)
Б) 1-хлорбутан и КОН(водн)
В) 1-хлорбутан и NH3
Взаимодействие серной кислоты с железом относится к реакциям:
Скорость реакции Zn + H2SO4 = ZnSO4 + Н2 уменьшится при
1. внесении катализатора
3. уменьшении концентрации кислоты
4. уменьшении давления в системе
5. добавлении ингибитора
Установите соответствие между формулой соли и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества.
Установите соответствие между названием соли и ее способностью к гидролизу.
Б) сульфид алюминия
В) ортофосфат калия
СПОСОБНОСТЬ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется и по катиону, и по аниону
4) не подвергается гидролизу
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе:
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
Установите соответствие между веществами и реагентом, с помощью которого их можно отличить друг от друга.
А) ацетилен и этилен
В) этандиол-1,2 и этанол
В качестве удобрений используют нитраты
Сколько граммов едкого натра следует растворить в 300 г 5%-ного раствора для получения 10%-ного раствора NaOH? (Запишите число с точностью до десятых.)
Какой объём газа (н.у.) не вступит в реакцию, если сжигать 40 л угарного газа в 40 л кислорода? (Запишите число с точностью до целых.)
Рассчитайте массу бромида железа(III), образующегося при действии избытка брома на 2,16 г бромида железа(II). (Запишите число с точностью до целых.)
Часть 2.
Запишите сначала номер задания (30, 31 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем его полное растворение с образованием тёмно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди.
Запишите уравнения описанных реакций.
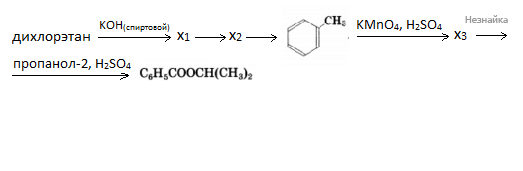
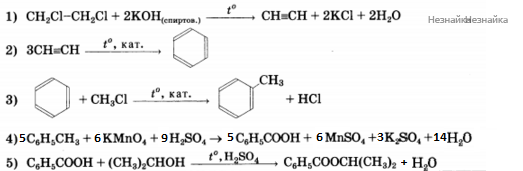
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических соединений.
Рассчитайте массовую долю азотной кислоты в растворе, полученном смешением 200 мл 15%-ного раствора серной кислоты плотностью 1,2 г/мл и 150 мл 10%-ного раствора нитрата бария плотностью 1,04 г/мл.
При сгорании 4,6 г органического вещества образуется 8,8 г углекислого газа и 5,4 г воды. Указанное вещество жидкое при н.у., реагирует с металлическим натрием и масляной кислотой. На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) приведите уравнение реакции его взаимодействия с масляной кислотой.
2) молекулярная формула C2H6O
3) структурная формула CH3—CH2—OH
Вариант 10
Часть 1.
Ответом к заданиям 1–26 является последовательность цифр. Цифры в ответах на задания 5, 10–12, 18, 19, 22–26 могут повторяться.
Хлорид-ион имеет такую же электронную конфигурацию, как и:
Расположите в порядке уменьшения атомного радиуса химические элементы:
Такую же степень окисления, как и в сернистом газе, атом серы имеет в соединениях
Немолекулярное строение имеют:
3. уксусная кислота
Установите соответствие между формулой вещества и классом, к которому это вещество принадлежит: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
3) оксид несолеобразующий
4) оксид амфотерный
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует алюминий.
2. нитрат серебра (р-р)
4. гидроксид железа(II)
5. оксид углерода(II)
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует оксид фосфора(V).
1. гидроксид натрия
Сокращённому ионному уравнению
отвечает взаимодействие веществ:
1. карбоната железа и гидроксида калия
2. хлорида железа и гидроксида натрия
3. нитрата железа и гидроксида меди
4. нитрата железа и гидроксида бария
5. сульфата железа и гидроксида бария
Задана следующая схема превращений веществ:
[math]Fe\xrightarrow XFeCl_3\xrightarrow YFe(OH)_3[/math]
Определите, какие из указанных веществ являются веществами X и Y.
Установите соответствие между формулой вещества и степенью окисления азота в ней.
СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА
Установите соответствие между исходными веществами и основным продуктом их взаимодействия.
А) Аl(ОН)3 + RbOH (водн. р-р)
Б) Аl(ОН)3 + Rb2O
В) Аl(ОН)3 + CsOH
Г) Аl(ОН)3 + Cs2CO3
Установите соответствие между названием органического соединения и классом, к которому оно принадлежит.
3) предельные спирты
5) предельные карбоновые кислоты
6) ненасыщенные карбоновые кислоты
Циклопропан, в отличие от пропана, реагирует с
Этаналь, в отличие от этанола, реагирует с
3. гидроксидом меди(II)
5. гидроксидом железа(III)
Из предложенного перечня выберите два вещества, с которыми реагируют и глицин, и этиламин.
3. фосфорная кислота
5. оксид углерода(II)
В заданной схеме превращений
[math]CH_3COOH\xrightarrow XCICH_2COOH\xrightarrow YNH_2CH_2COOH[/math]
веществами X и Y соответственно являются:
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
А) хлорэтан и натрий
Б) хлорэтан и КОН(спирт.)
Г) бутен-2 и водород
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
А) 2-хлорбутан и KOH(спиртов.)
Б) 1-хлорбутан и КОН(водн)
В) 1-хлорбутан и NH3
Взаимодействие серной кислоты с железом относится к реакциям:
Скорость реакции Zn + H2SO4 = ZnSO4 + Н2 уменьшится при
1. внесении катализатора
3. уменьшении концентрации кислоты
4. уменьшении давления в системе
5. добавлении ингибитора
Установите соответствие между формулой соли и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества.
Установите соответствие между названием соли и ее способностью к гидролизу.
Б) сульфид алюминия
В) ортофосфат калия
СПОСОБНОСТЬ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется и по катиону, и по аниону
4) не подвергается гидролизу
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе:
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
Установите соответствие между веществами и реагентом, с помощью которого их можно отличить друг от друга.
А) ацетилен и этилен
В) этандиол-1,2 и этанол
В качестве удобрений используют нитраты
Сколько граммов едкого натра следует растворить в 300 г 5%-ного раствора для получения 10%-ного раствора NaOH? (Запишите число с точностью до десятых.)
Какой объём газа (н.у.) не вступит в реакцию, если сжигать 40 л угарного газа в 40 л кислорода? (Запишите число с точностью до целых.)
Рассчитайте массу бромида железа(III), образующегося при действии избытка брома на 2,16 г бромида железа(II). (Запишите число с точностью до целых.)
Часть 2.
Запишите сначала номер задания (30, 31 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем его полное растворение с образованием тёмно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди.
Запишите уравнения описанных реакций.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических соединений.
Рассчитайте массовую долю азотной кислоты в растворе, полученном смешением 200 мл 15%-ного раствора серной кислоты плотностью 1,2 г/мл и 150 мл 10%-ного раствора нитрата бария плотностью 1,04 г/мл.
При сгорании 4,6 г органического вещества образуется 8,8 г углекислого газа и 5,4 г воды. Указанное вещество жидкое при н.у., реагирует с металлическим натрием и масляной кислотой. На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) приведите уравнение реакции его взаимодействия с масляной кислотой.
2) молекулярная формула C2H6O
3) структурная формула CH3—CH2—OH
Вариант 10
Часть 1.
Ответом к заданиям 1–26 является последовательность цифр. Цифры в ответах на задания 5, 10–12, 18, 19, 22–26 могут повторяться.
Хлорид-ион имеет такую же электронную конфигурацию, как и:
Расположите в порядке уменьшения атомного радиуса химические элементы:
Такую же степень окисления, как и в сернистом газе, атом серы имеет в соединениях
Немолекулярное строение имеют:
3. уксусная кислота
Установите соответствие между формулой вещества и классом, к которому это вещество принадлежит: к каждой позиции, данной в первом столбце, подберите соответствующую позицию из второго столбца.
3) оксид несолеобразующий
4) оксид амфотерный
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует алюминий.
2. нитрат серебра (р-р)
4. гидроксид железа(II)
5. оксид углерода(II)
Из предложенного перечня веществ выберите два вещества, с каждым из которых реагирует оксид фосфора(V).
1. гидроксид натрия
Сокращённому ионному уравнению
отвечает взаимодействие веществ:
1. карбоната железа и гидроксида калия
2. хлорида железа и гидроксида натрия
3. нитрата железа и гидроксида меди
4. нитрата железа и гидроксида бария
5. сульфата железа и гидроксида бария
Задана следующая схема превращений веществ:
[math]Fe\xrightarrow XFeCl_3\xrightarrow YFe(OH)_3[/math]
Определите, какие из указанных веществ являются веществами X и Y.
Установите соответствие между формулой вещества и степенью окисления азота в ней.
СТЕПЕНЬ ОКИСЛЕНИЯ АЗОТА
Установите соответствие между исходными веществами и основным продуктом их взаимодействия.
А) Аl(ОН)3 + RbOH (водн. р-р)
Б) Аl(ОН)3 + Rb2O
В) Аl(ОН)3 + CsOH
Г) Аl(ОН)3 + Cs2CO3
Установите соответствие между названием органического соединения и классом, к которому оно принадлежит.
3) предельные спирты
5) предельные карбоновые кислоты
6) ненасыщенные карбоновые кислоты
Циклопропан, в отличие от пропана, реагирует с
Этаналь, в отличие от этанола, реагирует с
3. гидроксидом меди(II)
5. гидроксидом железа(III)
Из предложенного перечня выберите два вещества, с которыми реагируют и глицин, и этиламин.
3. фосфорная кислота
5. оксид углерода(II)
В заданной схеме превращений
[math]CH_3COOH\xrightarrow XCICH_2COOH\xrightarrow YNH_2CH_2COOH[/math]
веществами X и Y соответственно являются:
Установите соответствие между реагирующими веществами и органическим продуктом, который преимущественно образуется при взаимодействии этих веществ.
А) хлорэтан и натрий
Б) хлорэтан и КОН(спирт.)
Г) бутен-2 и водород
Установите соответствие между реагирующими веществами и углеродсодержащим продуктом, который образуется при взаимодействии этих веществ.
А) 2-хлорбутан и KOH(спиртов.)
Б) 1-хлорбутан и КОН(водн)
В) 1-хлорбутан и NH3
Взаимодействие серной кислоты с железом относится к реакциям:
Скорость реакции Zn + H2SO4 = ZnSO4 + Н2 уменьшится при
1. внесении катализатора
3. уменьшении концентрации кислоты
4. уменьшении давления в системе
5. добавлении ингибитора
Установите соответствие между формулой соли и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества.
Установите соответствие между названием соли и ее способностью к гидролизу.
Б) сульфид алюминия
В) ортофосфат калия
СПОСОБНОСТЬ К ГИДРОЛИЗУ
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролизуется и по катиону, и по аниону
4) не подвергается гидролизу
Установите соответствие между уравнением химической реакции и направлением смещения химического равновесия при увеличении давления в системе:
НАПРАВЛЕНИЕ СМЕЩЕНИЯ ХИМИЧЕСКОГО РАВНОВЕСИЯ
1) в сторону продуктов реакции
2) в сторону исходных веществ
3) практически не смещается
Установите соответствие между веществами и реагентом, с помощью которого их можно отличить друг от друга.
А) ацетилен и этилен
В) этандиол-1,2 и этанол
В качестве удобрений используют нитраты
Сколько граммов едкого натра следует растворить в 300 г 5%-ного раствора для получения 10%-ного раствора NaOH? (Запишите число с точностью до десятых.)
Какой объём газа (н.у.) не вступит в реакцию, если сжигать 40 л угарного газа в 40 л кислорода? (Запишите число с точностью до целых.)
Рассчитайте массу бромида железа(III), образующегося при действии избытка брома на 2,16 г бромида железа(II). (Запишите число с точностью до целых.)
Часть 2.
Запишите сначала номер задания (30, 31 и т. д.), затем подробное решение. Ответы записывайте чётко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции
Определите окислитель и восстановитель.
Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем его полное растворение с образованием тёмно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди.
Запишите уравнения описанных реакций.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
При написании уравнений реакций используйте структурные формулы органических соединений.
Рассчитайте массовую долю азотной кислоты в растворе, полученном смешением 200 мл 15%-ного раствора серной кислоты плотностью 1,2 г/мл и 150 мл 10%-ного раствора нитрата бария плотностью 1,04 г/мл.
При сгорании 4,6 г органического вещества образуется 8,8 г углекислого газа и 5,4 г воды. Указанное вещество жидкое при н.у., реагирует с металлическим натрием и масляной кислотой. На основании этих данных:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
2) запишите молекулярную формулу исходного органического вещества;
3) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
4) приведите уравнение реакции его взаимодействия с масляной кислотой.
2) молекулярная формула C2H6O
3) структурная формула CH3—CH2—OH
помогите по химии Периодический закон и периодическая система химических элементов. Строение атома. Строение вещества
А1. Число энергетических уровней и число внешних электронов атома хлора равны соответственно
А2. Число протонов, нейтронов и электронов в атоме изотопа 90 Sr соответственно равно:
1)38, 90, 38
2)38, 52, 38
3)90, 52, 38
4)38, 52, 90
А3. Ионы, имеющие такую же электронную конфигурацию, что и атом Ar, это:
1)K+ и S2-
2)K+ и Na+
3)Al3+ и S2-
4)Na+ и Al3+
А4. Электронная формула меди:
1)1s22s22p63s23p63d94s2
2)1s22s22p63s23p63d104s1
3)1s22s22p63s23p63d34s24p6
4)1s22s22p63s23p63d104s2
А5. Суммарное число электронов в частице NO2- равно:
А6. В этом ряду химические элементы расположены в порядке увеличения радиуса атомов:
1)B, C, N
2)Br, Cl, F
3)O, S, Se
4)Ca, Mg, Be
А7. Восстановительные свойства металлов одной подгруппы с увеличением порядкового номера элемента
1)ослабевают
2)не изменяются
3)возрастают
4)сначала возрастают, затем убывают
А8. Электроотрицательность в ряду Na – Mg – Al
1)не изменяется
2)уменьшается
3)увеличивается
4)сначала уменьшается, а затем
увеличивается
А9. Формула высшего гидроксида мышьяка:
1)As2O3
2)As2O5
3)HAsO2
4)H3AsO4
А10. В ряду оксидов MgO → Al2O3 → SiO2 свойства изменяются от
1)кислотных к амфотерным
2)амфотерных к основным
3)основных к кислотным
4)кислотных к основным
А11. Число водородных связей, которое может образовать каждая молекула этанола, равно
А12. Три σ- и две π – связи между атомами имеются в молекуле
1)пентана
2)этана
3)ацетилена
4)пропадиена
А13. Число электронов, которые участвуют в образовании химических связей в молекуле аммиака, равно
А14. Атомная кристаллическая решётка характерна для
1)алюминия и карбида кремния
2)серы и иода
3)оксида кремния и хлорида натрия
4)алмаза и бора
А15. Все вещества с молекулярными кристаллическими решётками
1)имеют металлический блеск
2)хорошие проводники электрического тока
3)обладают низкими температурами плавления
4)хорошо растворяются в воде
А16. Одинаковый вид химической связи имеют хлороводород и
1)хлор
2)хлорид натрия
3)вода
4)водород
А17. В этом соединении ковалентная связь образуется по донорно-акцепторному механизму:
1)KCl
2)CCl4
3)NH4Cl
4)CaCl2
А18. Какие из приведённых утверждений верны?
А. Вещества с молекулярной решёткой имеют низкие температуры плавления и низкую электропроводность.
Б. Вещества с атомной решёткой пластичны и обладают высокой электрической проводимостью
1) верно только А
2) верно только Б
3) верны оба утверждения
4) оба утверждения неверны
А19. Соединение с ионной связью образуется при взаимодействии
1)CH4 и O2
2)NH3 и HCl
3)C2H6 и HNO3
4)SO3 и H2O
А20. Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, неэлектропроводно, то его кристаллическая решётка
1)молекулярная
2)атомная
3)ионная
4)металлическая
А1. Число энергетических уровней и число внешних электронов атома хлора равны соответственно
3) 3, 7
А2. Число протонов, нейтронов и электронов в атоме изотопа 90 Sr соответственно равно:
2) 38, 52, 38
А3. Ионы, имеющие такую же электронную конфигурацию, что и атом Ar, это:
А4. Электронная формула меди:
А5. Суммарное число электронов в частице NO2- равно:
А6. В этом ряду химические элементы расположены в порядке увеличения радиуса атомов:
А7. Восстановительные свойства металлов одной подгруппы с увеличением порядкового номера элемента
А8. Электроотрицательность в ряду Na – Mg – Al
А9. Формула высшего гидроксида мышьяка:
А10. В ряду оксидов MgO → Al2O3 → SiO2 свойства изменяются от
3) основных к кислотным
А11. Число водородных связей, которое может образовать каждая молекула этанола, равно
2) 1
или 2 не уверена
А12. Три σ- и две π – связи между атомами имеются в молекуле
А13. Число электронов, которые участвуют в образовании химических связей в молекуле аммиака, равно
А14. Атомная кристаллическая решётка характерна для
А15. Все вещества с молекулярными кристаллическими решётками
3) обладают низкими температурами плавления
А16. Одинаковый вид химической связи имеют хлороводород и
А17. В этом соединении ковалентная связь образуется по донорно-акцепторному механизму:
А18. Какие из приведённых утверждений верны?
А. Вещества с молекулярной решёткой имеют низкие температуры плавления и низкую электропроводность.
Б. Вещества с атомной решёткой пластичны и обладают высокой электрической проводимостью
4) оба утверждения неверны
А19. Соединение с ионной связью образуется при взаимодействии
А20. Если вещество хорошо растворимо в воде, имеет высокую температуру плавления, неэлектропроводно, то его кристаллическая решётка