уробилиноген понижен в моче что это значит у ребенка
Уробилиноген понижен в моче что это значит у ребенка
Исследование мочи с помощью тест-полосок. Тест-полоски с реагентами, окраска которых зависит от концентрации определяемого вещества, ныне повсеместно применяются при анализе мочи. Есть тест-полоски для определения рН, удельного веса, присутствия крови, концентрации белка, кетоновых тел, глюкозы, нитритов, лейкоцитарной эстеразы и уробилиногена.
Точность определения у них разная, а результаты могут искажаться даже под действием часто присутствующих в моче веществ и других факторов. Тест-полоски широко используют благодаря их дешевизне и быстроте анализа, однако результаты следует истолковывать осторожно.
Цвет мочи у ребенка
В зависимости от концентрации моча может быть от почти прозрачной до темно-янтарной. Желтым цветом нормальная моча обязана главным образом урохрому. Другие пигменты — каротин, уробилин и билирубин — могут придать ей оранжевую окраску. Белая, похожая на молоко моча бывает у здоровых детей из-за выпадающего в осадок фосфата кальция (особенно если ее охлаждают); в редких случаях белая моча указывает на хилурию.
В моче грудных детей встречается розоватый осадок из уратов. Выпавшие в осадок ураты могут также давать «кирпичную пыль» на пеленках. Необычный цвет мочи часто вызывается пищевыми красителями, лекарственными средствами или некоторыми натуральными пищевыми продуктами, но может быть обусловлен пигментами, которые выделяются при разных болезнях. Для острого гломерулонефрита характерна коричневая моча (цвета крепкого чая или кока-колы, «ржавая» моча).
При гематурии моча может быть от бледно-розовой до ярко-красной. В таблице перечислены некоторые причины необычной окраски мочи.
Концентрация мочи у ребенка
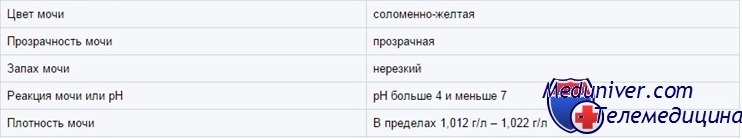
У детей старше 6 мес осмолярность мочи (показатель числа осмотически активных частиц) составляет от 50 до 1200 мосм/л. Осмолярность — самый точный показатель концентрации мочи, но ее сложно измерять. Удельный вес (вес одного миллилитра мочи по отношению к весу одного миллилитра Н2О) легко измерить, и он в целом коррелирует с осмолярностью. Однако при глюкозурии и сильно выраженной протеинурии осмолярность, определенная по удельному весу, будет завышенной.
Глюкоза и рентгеноконтрастные вещества не влияют на определение удельного веса при помощи тест-полосок, но белки влияют. Удельный вес мочи колеблется от 1,001 до 1,030 и выше. Удельный вес выше 1,030, возможно, означает присутствие экзогенного вещества (например, рентгеноконтрастного).
pH мочи у ребенка
рН мочи колеблется от 4,5 до 8 и зависит от питания (чем больше белка, тем ниже рН), состояния КЩР и длительности хранения. Кислая (рН
Белок в моче у ребенка
В норме моча содержит следовые количества белка (
Глюкоза в моче у ребенка
В норме глюкоза в моче не определяется (исключение — недоношенные дети). В тест-полосках обычно используется глюкозооксидазная реакция, специфичная по отношению к глюкозе. Другой метод — проба Бенедикта — основан на восстановлении ионов меди. Проба Бенедикта определяет все восстановители, включая глюкозу, и с ее помощью выявляют врожденные нарушения метаболизма Сахаров, например галактоземию.
Глюкозурия чаще всего возникает вследствие гипергликемии (избыток глюкозы попадает в мочу), но иногда отражает наследственное нарушение почечного транспорта глюкозы или же является частью общего нарушения функции проксимальных канальцев (синдрома Фанкони). У сильно недоношенных детей глюкозурия может быть вызвана незрелостью почечных канальцев.
Нитриты в моче у ребенка
Анализ на нитриты (с реактивом Грисса) используют, чтобы выявить бактериурию. Обычно в моче нитритов нет, но есть нитраты. Грамотрицательные бактерии восстанавливают нитраты до нитритов, но это занимает несколько часов. Поэтому положительная реакция возможна только при наличии в моче нитратов, выраженной бактериурии и достаточном для образования нитритов времени. Отрицательный результат еще не исключает бактериурию; при высоком уровне аскорбиновой кислоты возможен ложноотрицательный результат.
Лейкоцитарная эстераза в моче у ребенка
По лейкоцитарной эстеразе определяют лейкоцитурию. Если моча загрязнена влагалищными выделениями, результат будет положительным и в отсутствие инфекции мочевых путей или лейкоцитурии. Положительный результат нужно подтверждать исследованием осадка мочи под микроскопом.
Гемоглобин, миоглобин, эритроциты в моче у ребенка
Гемоглобин и миоглобин дают с реагентами на тест-полоске в зависимости от концентрации зеленое либо синее окрашивание. Кроме того, эти реагенты лизируют эритроциты, так что внутриклеточный гемоглобин тоже вступает в реакцию. Ее чувствительность оценивают как 5—20 эритроцитов в поле зрения при большом увеличении микроскопа, или 0,015 мг% гемоглобина.
В моче часто встречаются следы гемоглобина; обычно это не говорит о болезни. Положительные результаты нужно сопоставить с микроскопией мочевого осадка. Отсутствие эритроцитов при микроскопии может означать, что реакцию дает свободный гемоглобин или миоглобин, но чаще — что эритроциты просто успели лизироваться.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Уробилиноген в моче
Уробилиноген – это метаболит билирубина (желчный пигмент), который окрашивает мочу в золотистый (соломенный) оттенок. Анализ на уробилиноген проводится в рамках общего анализа мочи (ОАМ) с целью оценки состояния и функциональности органов гепатобилиарной и мочевыделительной систем.
Общие сведения
В результате распада гемоглобина эритроцитов высвобождается билирубин, который является весьма токсичным компонентом. Связываясь с глюкуроновой кислотой (процесс этот происходит в печени), билирубин теряет возможность негативно влиять на организм. Вместе с желчью он поступает в кишечник, где ферментируется, окисляется, метаболизируется (распадается), в результате чего появляется уробилиноген.
Полученный желчный пигмент частично направляется с кровотоком к почкам и выводится с мочой, придавая ей характерный желтый цвет. Оставшаяся часть уробилиногена при продвижении в толстый кишечник трансформируется в стеркобилин и выводится с каловыми массами, придавая им естественный коричневый оттенок.
В норме незначительное количество уробилиногена всегда присутствует в моче, хотя лабораторно может и не определяться. Повышение концентрации обусловлено:
Отсутствие уробилиногена в моче указывает на то, что билирубин не поступает в просвет кишечника. Как правило, подобная ситуация наблюдается при закупорке желчных протоков, свищах, гепатитах, печеночной недостаточности, деструктуризации ткани печени и т.д.
Показания для анализа
Исследование на уробилиноген проводится в рамках общего анализа мочи, особенно нужно обратить внимание на результаты при следующих симптомах:
Интерпретацию результатов анализа на уробилиноген проводит нефролог, инфекционист, уролог, гинеколог, семейный врач, педиатр, терапевт, функциональный диагност.
Нормы уробилиногена
Нормальными считаются значения, не превышающие 34 ммоль/л.
Факторы влияния
Уробилиноген и билирубин
Если повторный ОАМ выявил повышенный уробилиноген, необходимо учитывать и факт наличия билирубина в моче.
Повышение значений
Понижение значений
Данный факт обычно не представляет диагностической ценности для специалистов. Но если уробилиноген понижен/отсутствует на фоне повышенного билирубина, то следует исключить ряд патологий:
Уробилиноген у беременных и детей
Для будущих мам определены те же референсные значения, что и для всех остальных. Допускается временное повышение уровня уробилиногена, которое связано с ростом матки и увеличением нагрузи на почки и желудочно-кишечный тракт.
Важно! В случае резкого потемнения мочи необходимо срочно сдать анализ на уробилиноген для исключения патологий печени или острой интоксикации. Вероятность развития заболеваний органов гепатобилиарной системы повышается у женщин, имеющих наследственную предрасположенность.
В большинстве случаев концентрация уробилиногена увеличивается на фоне обезвоживания. Моча при этом становится более плотной и насыщенной. Обезвоживание может быть спровоцировано не только недостаточным потреблением жидкости, но и изменением суточного рациона, приемом биодобавок и витаминов, а также некоторых других препаратов. Обезвоживание наблюдается и на ранних сроках беременности (токсикоз первой половины). Данное состояние сопровождается значительным повышением уробилиногена в моче (в 2-3 раза).
У детей уробилиноген в норме не должен превышать 3,2 ммоль/л. В случае повышения концентрации проводится дифференциальная диагностика следующих заболеваний:
Важно! Все материалы носят справочный характер и ни в коей мере не являются альтернативой очной консультации специалиста.
Этот сайт использует cookie-файлы для идентификации посетителей сайта: Google analytics, Yandex metrika, Google Adsense. Если для вас это неприемлемо, пожалуйста, откройте эту страницу в анонимном режиме.
Общий анализ мочи
Общий анализ мочи включает оценку физико-химических характеристик мочи и микроскопию осадка. Данное исследование позволяет оценить функцию почек и других внутренних органов, а также выявить воспалительный процесс в мочевых путях. Вместе с общим клиническим анализом крови результаты этого исследования способны довольно много рассказать о процессах, происходящих в организме человека и, главное — указать направление дальнейшего диагностического поиска.
Физико-химические характеристики мочи:
Микроскопия мочевого осадка (исследование делается при патологии в общем анализе мочи или по требованию заказчика):
Организованный осадок мочи:
Показания к назначению анализа:
Подготовка к исследованию:
Накануне исследования не рекомендуется употреблять в пищу овощи и фрукты, которые могут изменить цвет мочи (свекла, морковь т.п.), а также диуретики. Перед сбором мочи произвести тщательный гигиенический туалет мочеполовых органов. Не рекомендуется женщинам сдавать анализ во время менструации. Посуда для сбора мочи должна быть чистой и сухой. Для правильного проведения забора мочи нужно: при первом утреннем мочеиспускании небольшое количество мочи выпустить в унитаз, а затем не прерывая мочеиспускания подставит посуду для сбора мочи, в которую собрать около 100-150 мл мочи.
Срок исполнения: 1 рабочий день.
Физико-химические характеристики.
Цвет.
Нормальная моча имеет соломенно-желтый цвет разной интенсивности. Цвет мочи у здоровых людей определяется присутствием веществ, образующихся из пигментов крови (уробилин, урохромы, гематопорфирин и др). Цвет мочи меняется в зависимости от ее относительной плотности, суточного объема и присутствия различных красящих компонентов, поступающих в организм человека с пищей, лекарственными препаратами, витаминами.
В норме, чем интенсивней желтый цвет мочи, тем выше ее относительная плотность и наоборот. Концентрированная моча имеет более яркий цвет. Однако нормальный цвет мочи еще не свидетельствует, что это моча здорового человека.
Прозрачность.
Нормальная свежевыпущенная моча прозрачна. Небольшое облако мути может появляться и в нормальной моче за счет эпителиальных клеток и слизи. Выраженное помутнение мочи может быть вызвано присутствием в ней эритроцитов, лейкоцитов, жира, эпителия, бактерий, значительного количества различных солей (уратов, фосфатов, оксалатов). Причины помутнения мочи выясняются при микроскопии осадка и с помощью химического анализа.
Используя трехстаканную пробу можно ориентировочно ответить на вопрос — из какого отдела мочевыводящей системы выделяются лейкоциты и слизь (из уретры, мочевого пузыря или почечных лоханок). Слегка мутная моча нередко наблюдается у пожилых людей (преимущественно из уретры). Возникающее помутнение мочи при стоянии на холоде обычно зависит от выпадения уратов, в тепле — фосфатов. Однако прозрачная моча еще не свидетельствует об отсутствии заболеваний мочеполовой системы.
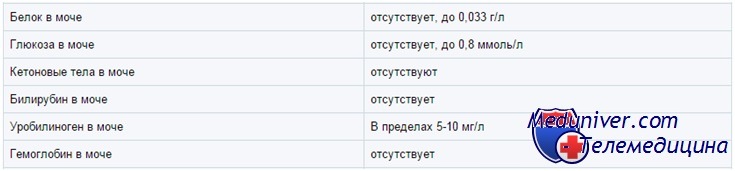
Белок.
Белок в норме в моче отсутствует или есть небольшие его следы, так как молекулы белка имеют большие размеры молекул, которые не в состоянии пройти через мембрану почечных клубочков.
Глюкоза.
В норме сахар в моче отсутствует, так как вся глюкоза у после фильтрации через мембрану клубочков почек полностью всасывается обратно в проксимальных канальцах.
Появление глюкозы в крови глюкозурия (glucosuria) может быть:
Билирубин.
Билирубин в норме в моче практически отсутствует. Образуется при разрушении гемоглобина в клетках ретикулоэндотелиальной системы, около 250-350 мг/сут. При повышении в крови концентрации конъюгированного билирубина он начинает выделяться почками и обнаруживается в моче. Билирубинурия (bilirubinuria) выявляется при паренхиматозных поражениях печени (вирусные гепатиты), механической (подпеченочной) желтухе, циррозах, холестазе. При гемолитической желтухе моча обычно билирубин не содержит. Необходимо отметить, что с мочой выделяется только прямой (связанный) билирубин.
Уробилиноген.
Уробилиногеновые тела (I-уробилиноген, d-уробилиноген, третий уробилиноген, стеркобилиноген) являются производными билирубина и являются нормальными продуктами катаболизма, которые в физиологических условиях образуются с определенной скоростью, постоянно экскретируются с калом и в небольших количествах с мочой. Нормальная моча содержит следы уробилиногена. Уровень его резко возрастает при гемолитической желтухе (внутрисосудистом разрушении эритроцитов), а также при токсических и воспалительных поражениях печени, кишечных заболеваниях (энтериты, запоры). При подпеченочной (механической) желтухе, когда наблюдается полная закупорка желчного протока, уробилиноген в моче отсутствует.
Кетоновые тела.
К кетоновым телам относятся ацетон, ацетоуксусная и бета-оксимаслянная кислоты. У здорового человека с мочой выделяется в сутки 20-30 мг кетонов. Увеличение выделения кетонов с мочой кетонурия (ketonuria) появляется при нарушении углеводного, жирового или белкового обменов.
Нитриты.
Нитриты в нормальной моче отсутствуют. В моче они образуются из нитратов пищевого происхождения (при употреблении растительной пищи) под влиянием бактерий, если моча не менее 4 ч находилась в мочевом пузыре. Обнаружение нитритов в моче (положительный результат теста) говорит об инфицировании мочевого тракта. Однако отрицательный результат не всегда исключает бактериурию. Инфицирование мочевого тракта варьирует в разных популяциях, зависит от возраста и пола. Повышенному риску асимптоматических инфекций мочевого тракта и хронического пиелонефрита при прочих равных условиях больше подвержены следующие категории людей:
Микроскопии мочевого осадка.
В мочевом осадке различают организованный осадок (клеточные элементы, цилиндры, слизь, бактерии, дрожжевые грибки) и неорганизованный (кристаллические элементы).
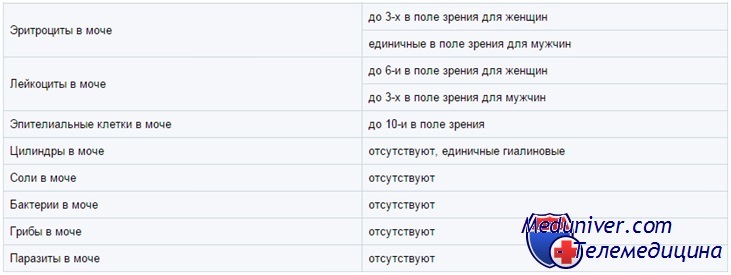
В мочевом осадке эритроциты могут быть неизменённые (содержащие гемоглобин) и изменённые (лишённые гемоглобина, выщелоченные). Появление в моче выщелоченных эритроцитов имеет большое диагностическое значение, т.к. они чаще всего имеют почечное происхождение и встречаются при гломерулонефритах, туберкулёзе и других заболеваниях почек.
Свежие неизменённые эритроциты более характеры для поражения мочевыводящих путей (мочекаменная болезнь, цистит, уретрит).
Для определения источника гематурии применяют пробу «трёх сосудов»: больной собирает мочу последовательно в три сосуда. При кровотечении из уретры гематурия бывает наибольшей в первой порции (неизменённые эритроциты), из мочевого пузыря — в последней порции (неизменённые эритроциты), при других источниках кровотечения эритроциты распределяются равномерно по всех трёх порциях.
Лейкоциты.
Лейкоциты в моче здорового человека содержатся в небольшом количестве (у мужчин 0–3, у женщин и детей 0–6 лейкоцитов в поле зрения). Увеличение числа лейкоцитов в моче (лейкоцитурия) свидетельствует о воспалительных процессах в почках (пиелонефрит) или мочевыводящих путях (цистит, уретрит). Для установления источника лейкоцитурии применяется трёхстаканная проба: преобладание лейкоцитов в первой порции указывает на уретрит или простатит, в третьей — на цистит, равномерное распределение лейкоцитов во всех порциях с большой вероятностью может свидетельствовать о поражении почек.
Возможна так называемая стерильная лейкоцитурия. Это наличие лейкоцитурии при отсутствии бактериурии и дизурии (при обострении хронического гломерулонефрита, загрязнения при сборе мочи, состояние после лечение антибиотиками, опухоли мочевого пузыря, туберкулёз почек, интерстициальный анальгетический нефрит).
Уретральный синдром. Это учащенное, болезненное мочеиспускание и лейкоцитурия в отсутствие бактериурии. Встречается преимущественно у женщин. В 30-40% случаев у женщин с симптомами инфекции мочевых путей не удаётся выявить бактериурию. Причины отрицательного результата в том, что истинным возбудителем данного состояния, как правило, являются анаэробные бактерии, уреаплазма, хламидии, гонококк, вирусы. А все они требуют посева на специальные среды.
Эпителиальные клетки.
В мочевом осадке практически всегда встречаются клетки эпителия. В норме их не больше 10 штук в поле зрения.
Эпителиальные клетки имеют различное происхождение:
Бактерии.
В норме моча в мочевом пузыре стерильна. При мочеиспускании в неё попадают микробы из нижнего отдела уретры, но их количество не > 10 000 в 1 мл. Под бактериурией понимается выявление более, чем одной бактерии в поле зрения (качественный метод), что предполагает рост колоний в культуре, превышающий 100 000 бактерий в 1 мл (количественный метод).
Дрожжевые грибки.
Обнаружение дрожжей рода Кандида свидетельствует о кандидамикозе, возникающего чаще всего в результате нерациональной антибиотикотерапии, приеме иммуносупрессоров, цитостатиков.
Определение вида грибка возможно только при бактериологическом исследовании.
Слизь.
Слизь выделяется эпителием слизистых оболочек. В норме отсутствует или присутствует в моче в незначительном количестве. При воспалительных процессах в нижних отделах мочевыводящих путей содержание слизи в моче повышается. Увеличенное количество слизи в моче может говорить о нарушении правил правильной подготовки к взятию пробы мочи.
Уробилиноген в моче
Уробилиноген – это метаболит билирубина (желчный пигмент), который окрашивает мочу в золотистый (соломенный) оттенок. Анализ на уробилиноген проводится в рамках общего анализа мочи (ОАМ) с целью оценки состояния и функциональности органов гепатобилиарной и мочевыделительной систем.
В результате распада гемоглобина эритроцитов высвобождается билирубин, который является весьма токсичным компонентом. Связываясь с глюкуроновой кислотой (процесс этот происходит в печени), билирубин теряет возможность негативно влиять на организм. Вместе с желчью он поступает в кишечник, где ферментируется, окисляется, метаболизируется (распадается), в результате чего появляется уробилиноген.
Полученный желчный пигмент частично направляется с кровотоком к почкам и выводится с мочой, придавая ей характерный желтый цвет. Оставшаяся часть уробилиногена при продвижении в толстый кишечник трансформируется в стеркобилин и выводится с каловыми массами, придавая им естественный коричневый оттенок.
В норме незначительное количество уробилиногена всегда присутствует в моче, хотя лабораторно может и не определяться. Повышение концентрации обусловлено:
Отсутствие уробилиногена в моче указывает на то, что билирубин не поступает в просвет кишечника. Как правило, подобная ситуация наблюдается при закупорке желчных протоков, свищах, гепатитах, печеночной недостаточности, деструктуризации ткани печени и т.д.
Исследование на уробилиноген проводится в рамках общего анализа мочи, особенно нужно обратить внимание на результаты при следующих симптомах:
Интерпретацию результатов анализа на уробилиноген проводит нефролог, инфекционист, уролог, гинеколог, семейный врач, педиатр, терапевт, функциональный диагност.
Нормальными считаются значения, не превышающие 34 ммоль/л.
Если повторный ОАМ выявил повышенный уробилиноген, необходимо учитывать и факт наличия билирубина в моче.
Данный факт обычно не представляет диагностической ценности для специалистов. Но если уробилиноген понижен/отсутствует на фоне повышенного билирубина, то следует исключить ряд патологий:
Для будущих мам определены те же референсные значения, что и для всех остальных. Допускается временное повышение уровня уробилиногена, которое связано с ростом матки и увеличением нагрузи на почки и желудочно-кишечный тракт.
Важно! В случае резкого потемнения мочи необходимо срочно сдать анализ на уробилиноген для исключения патологий печени или острой интоксикации. Вероятность развития заболеваний органов гепатобилиарной системы повышается у женщин, имеющих наследственную предрасположенность.
В большинстве случаев концентрация уробилиногена увеличивается на фоне обезвоживания. Моча при этом становится более плотной и насыщенной. Обезвоживание может быть спровоцировано не только недостаточным потреблением жидкости, но и изменением суточного рациона, приемом биодобавок и витаминов, а также некоторых других препаратов. Обезвоживание наблюдается и на ранних сроках беременности (токсикоз первой половины). Данное состояние сопровождается значительным повышением уробилиногена в моче (в 2-3 раза).
У детей уробилиноген в норме не должен превышать 3,2 ммоль/л. В случае повышения концентрации проводится дифференциальная диагностика следующих заболеваний:
Диcметаболические нефропатии у детей
Диcметаболические нефропатии (ДН) — группа заболеваний с различной этиологией и патогенезом, которые характеризуются интерстициальным процессом с поражением канальцев почек вследствие нарушения обмена веществ. В широком смысле слова к ДН относятся любые
Диcметаболические нефропатии (ДН) — группа заболеваний с различной этиологией и патогенезом, которые характеризуются интерстициальным процессом с поражением канальцев почек вследствие нарушения обмена веществ. В широком смысле слова к ДН относятся любые связанные с различными нарушениями обмена заболевания, которые приводят к изменениям функционального состояния почек или структурным сдвигам на уровне различных элементов нефрона [2, 3, 5].
Любые ДН характеризуются перенасыщением мочи теми или иными веществами и мочевым синдромом в виде кристаллурии.
В процессе кристаллообразования играют роль три принципиальных фактора: перенасыщение канальцевой жидкости сверх пределов ее стабильности, снижение активности ингибиторов перенасыщения, активаторы преципитации [5, 6].
Для образования кристалла необходимо наличие ионной пары — аниона и катиона (например, иона кальция и иона оксалата). Перенасыщение мочи различными видами ионов в конечном итоге приводит к их преципитации в виде кристаллов и последующему их росту. Огромную роль при этом играет дегидратация мочи, что влечет за собой повышение концентрации ионов в моче даже при их нормальной продукции.
Кроме степени насыщения, на растворимость ионов влияют ионная сила, способность к комплексообразованию, скорость тока и рН мочи. Важным активатором кристаллообразования является инфекция мочевой системы, особенно микроорганизмы, продуцирующие уреазу и способные расщеплять мочевину.
Персистирующая кристаллурия может приводить к отложению кристаллов в ткани почки и развитию асептического тубулоинтерстициального воспаления, а также к их адгезии, что служит основой формирования камня и развития мочекаменной болезни [3, 5, 6].
В зависимости от причины развития выделяют первичные и вторичные ДН. Первичные ДН являются наследственно обусловленными заболеваниями, характеризуются прогрессирующим течением, ранним развитием уролитиаза и хронической почечной недостаточности.
Вторичные ДН представляют собой вторичные тубулярные синдромы, иначе называемые дисметаболическими расстройствами с кристаллуриями, которые могут быть полигенно наследуемыми или мультифакториальными. Вторичные ДН могут быть связаны с повышенным поступлением определенных веществ в организм, нарушением их метаболизма в связи с поражением других органов и систем (например, желудочно-кишечного тракта), лекарственной терапией, нестабильностью цитомембран канальцев и др. [1, 2, 3, 4, 5, 6].
Термины «дисметаболическая нефропатия» и «кристаллурия» не являются синонимами. Кристаллурия представляет собой вариант мочевого синдрома, при котором в моче выявляются кристаллы различных солей. Наиболее часто кристаллурия носит транзиторный характер и выявляется на фоне ОРВИ и других заболеваний, исчезает после прекращения основного заболевания. ДН предполагает развитие поражения канальцевого аппарата и не всегда (или по крайней мере не постоянно) сопровождается кристаллурией.
Подавляющее большинство кристаллурий и ДН связаны с кальцием (от 70 до 90%), около 85–90% из них — с оксалатами (в виде оксалата кальция), остальные с фосфатами (фосфаты кальция — 3–10%) или являются смешанными — оксалатно(фосфатно)-уратными. Уратная кристаллурия и литиаз составляют около 5% случаев, цистиновая — до 3%.
В 5–15% выявляются трипельфосфаты — фосфатные кристаллы, содержащие ион аммония, магний и кальций [5, 6].
По данным отделения нефрологии РДКБ за 2004 г., среди детей с ДН 68–71% составляли больные с оксалурией, примерно 15% — с оксалурией и фосфатурией, около 9% — с фосфатурией и приблизительно 5% — со вторичной цистинурией. Не было выявлено ни одного случая уратурии.
Первичные нарушения метаболизма встречаются довольно редко, поэтому мы рассмотрим преимущественно вторичные ДН.
Нарушения обмена оксалатов
Оксалатно-кальциевая кристаллурия наиболее часто встречается в детском возрасте. Ее патогенез может быть связан с нарушением как обмена кальция, так и обмена оксалатов. У большинства больных с оксалатно-кальциевой кристаллурией не выявляется выраженного нарушения метаболизма оксалатов или повышения их экскреции с мочой, но имеет место гиперкальциурия. Кристаллы оксалата кальция могут образовываться и при нормальном уровне кальция в моче вследствие повышения содержания оксалатов.
Оксалаты попадают в организм экзогенно с пищей или образуются эндогенно. Оксалаты полностью фильтруются в клубочках, затем реабсорбируются и секретируются в канальцах. Даже при небольшом повышении количества оксалатов в моче вследствие их высокой ионной силы высока вероятность выпадения кристаллов оксалата кальция [5, 6].
Причины гипероксалурии (Д. Фрейтаг, К. Хруска, 1987) следующие [6]:
ДН с оксалатно-кальциевой кристаллурией (оксалатная нефропатия) полиэтиологичное заболевание, в основе которого лежит нарушение стабильности почечных цитомембран как наследственного, так и спорадического характера. По данным различных авторов, доля генетических факторов в развитии оксалатной нефропатии составляет до 70–75%. Помимо генетических, большую роль играют средовые факторы: питание, стресс, экологическая нагрузка и др.
Нестабильность почечных цитомембран вследствие повышенной активности процессов перекисного окисления липидов приводит к ускоренному метаболизму мембранных фосфолипидов и высвобождению компонентов липидной оболочки — фосфатидилэтаноламина и фосфатидилсерина, окислению или окислительному переаминированию глицина, серина, этаноламина, аланина, пролина, одним из конечных продуктов чего является оксалат. Лабильность фосфолипидного слоя цитомембран может повлечь за собой кальцифилаксию — нарушение гомеостаза внутриклеточного кальция, приводящее к патологической кальцификации [2, 3, 7, 11].
Предшественником образования оксалатов является также аскорбиновая кислота, но количество оксалатов, образующихся из аскорбиновой кислоты, незначительно и имеет значение только при существующем нарушении обмена оксалатов [5].
Первые проявления болезни могут развиться в любом возрасте, даже в периоде новорожденности. Чаще всего они выявляются в 5–7 лет в виде мочевого синдрома с оксалатно-кальциевой и/или фосфатно-кальциевой кристаллурией, гематурией различной степени выраженности, небольшой протеинурией и/или лейкоцитурией абактериального характера. Снижена антикристаллообразующая способность мочи, определяются фосфолипидурия и повышение фосфолипазной активности мочи. Характерна гиперстенурия.
Морфологически выявляется деструкция апикальных поверхностей эпителия канальцев почек, лимфогистиоцитарная инфильтрация интерстиция.
В просветах канальцев и интерстиции обнаруживаются кристаллы оксалата кальция. При прогрессировании заболевания отмечаются явления склероза, вовлечение гломерул.
Общее развитие детей с оксалатной нефропатией, как правило, не страдает; для них характерны аллергии, ожирение, вегетативно-сосудистая дистония с тенденцией к гипотонии, лабильностью пульса, головными болями. Заболевание обостряется в период полового созревания в возрасте 10–14 лет, что, по-видимому, связано с дисбалансом нейрогуморальной регуляции и хроническим стрессом, в условиях которого повышается активность процессов перекисного окисления липидов цитомембран. Прогрессирование оксалатной нефропатии может привести к формированию мочекаменной болезни (МКБ), развитию тубулоинтерстициального нефрита (ТИН) или пиелонефрита при наслоении бактериальной инфекции.
Фосфатная кристаллурия
Первичная или истинная фосфатурия встречается при заболеваниях, сопровождающихся нарушением фосфорного и кальциевого обмена. Основная причина вторичной фосфатурии — хроническая инфекция мочевой системы. Особое значение в связи с этим имеют микроорганизмы с уреазной активностью. Уреаза разлагает мочевину с ощелачиванием мочи, что приводит к перенасыщению мочи фосфатами магния и аммония (струвит). Соединение струвита с углекислым аппатитом в различных количествах приводит к образованию трипельфосфатных кристаллов.
Фосфатурия может развиваться также вследствие нарушения кальциевого обмена при гиперкальциуриях, при этом кристаллы представлены в основном фосфатом кальция. Часто фосфатно-кальциевая кристаллурия сопровождает оксалатно-кальциевую, но при этом выражена в меньшей степени [5, 6].
Нарушения обмена мочевой кислоты
Мочевая кислота (урат) является конечным продуктом обмена пуринов. Следовательно, количество образующейся мочевой кислоты определяется количеством пуринов, поступивших с пищей, эндогенной продукцией и интенсивностью их перехода в мочевую кислоту. Большинство свободных пуриновых оснований утилизируется для ресинтеза пуриновых нуклеотидов.
За сутки в организме образуется 570–1000 мг мочевой кислоты, одна треть количества которой секретируется в кишечник и разрушается там бактериями. Остальные две трети фильтруются в клубочках в виде мононатриевой соли, большая часть которой реабсорбируется и только 6–12% от профильтровавшегося количества экскретируются.
На кристаллизацию мочевой кислоты влияют рН мочи, суточная экскреция мочевой кислоты и объем мочи. Мочевая кислота существует в диссоциированной (оксиформа) и недиссоциированной (оксоформа) формах. Оксоформа малорастворима (60–120 мг/л), тогда как оксиформа хорошо растворяется (1580 мг/л при рН = 7,0). При кислых значениях рН мочи мочевая кислота находится в оксоформе, при повышении рН растворимость мочевой кислоты резко возрастает (при изменении рН от 5 до 6 концентрация недиссоциированной формы снижается в 6 раз). В ночное время суток (во время сна) повышается экскреция уратов, снижается количество мочи, а также отсутствует подщелачивание мочи, что усугубляет риск выпадения кристаллов уратов [5, 6].
Первичные уратные нефропатии обусловлены наследственными нарушениями метаболизма мочевой кислоты. Вторичные возникают как осложнения других заболеваний (эритремии, миеломной болезни, хронической гемолитической анемии и др.), являются следствием применения некоторых препаратов (тиазидовые диуретики, цитостатики, салицилаты, циклоспорин А и др.) или нарушения функции канальцев почек и физико-химических свойств мочи (при пиелонефрите, ТИН и др.) [1, 2, 3, 10].
У больных с уратной нефропатией выявляется дефект почечной экскреции аммония, приводящий к избыточной экскреции титруемых кислот и снижению рН мочи. Причинами экскреции постоянно кислой мочи могут быть заболевания желудочно-кишечного тракта, сопровождающиеся диареей, вследствие дегидратации и/или потери бикарбонатов, а также при илеостоме, лекарственно-индуцированной ацидификации.
Кристаллы уратов натрия откладываются в первую очередь в области петель Генле, где наблюдается наиболее высокая концентрация натрия; быстро появляется обструкция собирательных трубочек с последующей гипотрофией и атрофией проксимальных канальцев, их вторичным некрозом и фиброзом. В интерстиции наблюдаются фиброз и лимфогистиоцитарная инфильтрация, характерные для ТИН. Постепенно поражаются клубочки — от частичного до полного гиалиноза. Все это приводит к прогрессированию склероза и снижению почечных функций [3, 5, 10].
Первые признаки заболевания могут выявляться в раннем возрасте, хотя в большинстве случаев наблюдается длительное латентное течение процесса. Мочевой синдром характеризуется уратной кристаллурией, небольшой протеинурией, гематурией различной степени выраженности. При наличии большого количества уратов моча приобретает кирпичный цвет. При развитии абактериального воспаления в тубулоинтерстиции появляется абактериальная лейкоцитурия, которая в случае присоединения инфекции становится бактериальной. Возможно образование уратных или смешанных камней с включением оксалатов и фосфатов.
В родословной больных с гиперуратурией определяются: сосудистая патология, спондилез, артропатии, сахарный диабет, нефропатии, МКБ, ожирение, подагра.
Нарушения обмена цистина
Цистин является продуктом метаболизма метионина и представляет собой наименее растворимую из встречаемых в природе аминокислот. Порог растворимости цистина при рН = 7,0 составляет не более 400 мг/л, превышение этой концентрации в растворе ведет к выпадению кристаллов цистина в осадок. Кристаллы цистина имеют характерную форму шестигранников. Вторым условием выпадения кристаллов цистина является кислая реакция мочи [4, 5, 6, 9].
Можно выделить две основные причины повышения концентрации цистина в моче: избыточное накопление цистина в клетках почки и нарушение обратного всасывания цистина в почечных канальцах.
Накопление цистина в клетках происходит в результате генетического дефекта лизосомального фермента цистинредуктазы, восстанавливающей цистин в цистеин. Это нарушение обмена носит системный характер и называется цистинозом. Внутриклеточное и внеклеточное накопление кристаллов цистина выявляется не только в канальцах и интерстиции почки, но и в печени, селезенке, лимфоузлах, костном мозге, клетках периферической крови, нервной и мышечной ткани, других органах [9].
Нарушение обратного всасывания цистина в канальцах почек наблюдается при цистинурии вследствие генетически обусловленного дефекта мембранного транспорта для цистина, аргинина, лизина и орнитина. Гиперэкскреция лизина, аргинина и орнитина в развитии кристаллурии, нефролитиаза и нарушении функции почек особой роли не играет [2, 4, 5].
Однако наиболее часто кристаллы цистина выявляются при нефропатиях с преимущественным поражением канальцевого аппарата почек (пиелонефрит, ТИН), и такая цистинурия носит вторичный характер. Если кристаллы оксалатов, уратов, фосфатов могут появляться эпизодически и при различных колебаниях в диете, то наличие цистина в моче — всегда признак патологии.
Морфологически в почечной паренхиме обнаруживаются кристаллы цистина, имеющие типичную гексагональную форму, часто они выявляются в виде скопления прямоугольных или даже аморфных кристаллов. Кристаллы выявляются в просвете проксимальных канальцев и обтурируют их. В интерстиции определяется лимфогистиоцитарная инфильтрация. По мере прогрессирования ТИН развиваются явления фиброза. Определяются признаки нефролитиаза, а при присоединении инфекции — пиелонефрита.
Общие подходы к диагностике ДН у детей
Только комплексная оценка образа жизни ребенка, характера питания, факторов окружающей среды, семейного анамнеза и результатов лабораторно-инструментальных методов исследования позволяет поставить диагноз ДН.
Лабораторно-инструментальная диагностика ДН основывается на выявлении кристаллурии в общем анализе мочи, повышении концентрации тех или иных солей в биохимическом исследовании мочи, исследовании антикристаллообразующей способности мочи (АКОСМ), проведении тестов на кальцифилаксию и перекиси в моче, УЗИ почек.
Выявление кристаллов солей только в общих анализах мочи не является основанием для постановки диагноза ДН. Следует иметь в виду, что кристаллурия у детей часто бывает транзиторной и оказывается не связана с патологией обмена и нестабильностью почечных цитомембран.
Для подтверждения диагноза ДН при выявлении кристаллурии в общем анализе мочи проводится биохимическое исследование мочи, в рамках которого следует обратить внимание на концентрацию солей (оксалаты, мочевая кислота, кальций, фосфор и др.) и показатели функции канальцев (глюкоза, титруемая кислотность, аммиак, рН и др.), что позволяет не только выявить степень повышения экскреции тех или иных веществ, но и оценить условия для кристаллообразования, степень вовлеченности тубулярного аппарата в патологический процесс.
Повышение экскреции солей, по данным биохимического исследования мочи при нормальных общих анализах мочи и отсутствии изменений при УЗИ почек, также не может в полной мере свидетельствовать о наличии ДН у ребенка, однако позволяет поставить диагноз, например: гипероксалурия, гиперуратурия и т. д.
При подозрении на ДН отсутствие кристаллурии и повышенной экскреции солей с мочой у ребенка в данный момент не позволяет окончательно исключить этот диагноз. Нормальные показатели в общем и биохимическом анализах мочи могут быть обусловлены, например, правильной диетой и режимом жизни ребенка в данный период, тогда как предпосылки к тем или иным обменным нарушениям сохраняются. При этом даже нормальные показатели концентрации солей в биохимическом анализе мочи могут являться «пороговыми» с позиций растворимости для данного ребенка; либо склонность к кристаллообразованию может быть обусловлена отсутствием или снижением ингибиторов кристаллообразования.
Поэтому важно определить способность мочи растворять различные соли. Для этой цели проводится анализ на АКОСМ к оксалатам кальция, фосфатам кальция и трипельфосфатам, наиболее часто встречающимся при кристаллуриях у детей. В нормальной моче способность растворять эти соли и предотвращать кристаллообразование сохраняется за счет наличия ингибиторов кристаллообразования и отсутствия или малой активности активаторов кристаллообразования. АКОСМ при ДН снижена в различной степени за счет повышения концентрации этих солей в растворенном виде и/или нарушения баланса ингибиторов и активаторов.
Тест на кальцифилаксию позволяет выявить наличие нарушения клеточного гомеостаза кальция, приводящего к патологической кальцификации клеток и тканей. Тест на перекиси в моче отражает активность процессов перекисного окисления липидов цитомембран [5, 7].
Изменения, выявляемые при УЗИ почек, как правило, малоспецифичны. Возможно выявление в почке микролитов или включений, дающих эхонегативные «дорожки», что может послужить показанием для проведения рентгенологического исследования.
Этапная диагностика некоторых ДН представлена в таблице 2 (см. рубрику «Под стекло»).
Основные принципы терапии ДН
Лечение любой ДН можно свести к четырем основным принципам:
Нормализация образа жизни, физическое и психическое здоровье являются важным условием для достижения положительного эффекта в терапии ДН. Выраженные и длительные нарушения этих составляющих в конечном счете реализуются в микроциркуляторных отклонениях, ведущих к гипоксии, и/или в непосредственном повреждающем воздействии на клетки. Все это активизирует и/или усугубляет нарушения клеточного обмена, интенсивность перекисного окисления липидов мембран, их нестабильность и т. д.
Прием большого количества жидкости является универсальным способом лечения любой ДН, так как способствует уменьшению концентрации растворимых веществ в моче. Также важно время приема жидкости, особенно в периоды максимальной суточной концентрации мочи, т. е. во время сна. Поэтому одной из целей лечения является никтурия, что достигается приемом жидкости перед сном. Предпочтение следует отдавать простой или минеральной воде, поскольку длительный прием жидкостей, например, подкисляющих мочу или содержащих углеводы, может вызвать увеличение экскреции кальция [6].
Диета позволяет в значительной степени снизить метаболическую нагрузку на тубулярный аппарат.
Специфическая терапия должна быть направлена на предупреждение кристаллообразования, выведение солей, нормализацию обменных и энергетических процессов. Поскольку в большинстве случаев мембранопатия у детей является одним из звеньев патогенеза ДН, следует помнить об антиоксидантной и мембраностабилизирующей терапии.
При лечении больных с оксалатной нефропатией назначается картофельно-капустная диета, при которой снижается поступление оксалатов с пищей и нагрузка на тубулярный аппарат. Необходимо исключить экстрактивные мясные блюда, богатые оксалатами щавель, шпинат, клюкву, свеклу, морковь, какао, шоколад и др. «Подщелачивающий» эффект оказывают курага, чернослив, груши.
Из минеральных вод используются такие, как славяновская и смирновская, по 3–5 мл/кг/сут в 3 приема курсом 1 мес 2–3 раза в год.
Медикаментозная терапия включает мембранотропные препараты и антиоксиданты [3, 5, 7]. Лечение должно быть и длительным.
Пиридоксин (витамин В6) назначается в дозе 1–3 мг/кг/сут (до 400 мг/сут) в течение 1 мес ежеквартально. Витамин В6 оказывает мембраностабилизирующее действие за счет участия в обмене жиров в качестве антиоксиданта и обмене аминокислот. Целесообразно также назначение препарата магнеВ6 из расчета 5–10 мг/кг/сут курсом в течение 2 мес 3 раза в год.
Мембраностабилизирующее действие оказывает витамин А, который встраивается в билипидный слой и нормализует взаимодействие белков и липидов мембраны. Суточная доза витамина А 1000 МЕ на год жизни ребенка, курсом — 1 мес ежеквартально.
Токоферола ацетат (витамин Е) является мощным антиоксидантом, который поступает в организм извне и вырабатывается эндогенно. Необходимо помнить, что экзогенное введение витамина Е может тормозить его эндогенную продукцию по механизму отрицательной обратной связи. Витамин Е укрепляет белково-липидные связи клеточных мембран, участвует в процессах акцепции электронов при свободнорадикальных реакциях на мембранах. Назначается с витамином А в дозе 1–1,5 мг/кг массы в сутки.
В качестве мембраностабилизаторов использутся димефосфон и ксидифон. Димефосфон восстанавливает связь между окислением и фосфорилированием в клеточном дыхании, разобщенность которого наблюдается при нестабильности митохондриальных мембран, прерывая каскадные процессы перекисного окисления липидов. Применяется в дозе 1 мл 15% раствора на каждые 5 кг веса, 3 приема в сутки. Курс — 1 мес, 3 раза в год.
Ксидифон является комплексообразующим препаратом, который облегчает включение кальция в митохондрии и предупреждает отложение его нерастворимых солей. Назначается в дозе 10 мг/кг/сут 2% раствора в 3 приема. Курс — 1 мес, 2 раза в год.
Показана высокая эффективность цистона, особенно при кристаллурии. Цистон назначается в дозе 1–2 таблетки 2–3 раза в день курсом от 3 до 6 мес.
Помимо этого, назначается окись магния, особенно при первичной гипероксалурии, в дозе 0,15–0,2 г/сут. При первичной гипероксалурии следует иметь в виду, что любая терапия является паллиативной. Радикальным методом лечения оксалоза является трансплантация печени, что устраняет дефект отсутствия аланин-глиоксилаттрансферазы и восстанавливает нормальный обмен оксалатов.
При лечении уратной нефропатии диета предусматривает исключение богатых пуриновыми основаниями продуктов (печень, почки, мясные бульоны, горох, фасоль, орехи, какао и др.). Преимущество должно отдаваться продуктам молочного и растительного происхождения. Важным условием успешной терапии является достаточное употребление жидкости — от 1 до 2 л в сутки. Предпочтение следует отдавать слабощелочным и слабоминерализованным водам, отварам трав (хвощ полевой, укроп, лист березы, брусничный лист, клевер пашенный, спорыш и др.), отвару овса. Для поддержания рН мочи в пределах 6,2–6,6 можно использовать цитратные смеси (уралит-У, блемарен, магурлит, солимок и др.), которые обладают значительной буферной емкостью [3, 4, 5, 8, 10].
При гиперурикемии важно уменьшить концентрацию мочевой кислоты до 6 мг/100 мл и менее. Для этого используются средства, снижающие синтез мочевой кислоты — ингибиторы ксантиноксидазы. Применение в педиатрии аллопуринола ограничено из-за возможных осложнений — гепатит, эпидермальный некроз, алопеция, лейко- и тромбоцитопения, повышение уровня ксантина в крови. Под строгим контролем аллопуринол назначают в дозе 0,2–0,3 г/сут в 2–3 приема в течение 2–3 нед, затем доза снижается. Длительность общего курса — до 6 мес. Никотинамид является более слабым ингибитором активности ксантиноксидазы, чем аллопуринол, но лучше переносится; назначается в дозе 0,005–0,025 г 2–3 раза в сутки по 1–2 мес повторными курсами. Колхицин снижает транспорт пуриновых оснований и скорость их обмена. Назначается в дозе 0,5–2 мг/сут сроком от 18 мес до нескольких лет.
Урикозурическим эффектом обладают оротовая кислота, цистон, этамид, цистенал, фитолизин и др. Калия оротата таблетки назначаются в дозе 10 мг/кг в сут в 2–3 приема в течение 1 мес. Урикозурическим и урикостатическим действием обладает также бензбромарон, который применяют по 50–100 мг/сут 2–3 раза в сочетании с салуретиками и цитратом натрия [3, 4, 5, 8].
В качестве мембранотропных средств используют ксидифон и витамин В6.
Лечение при фосфатной кристаллурии должно быть направлено на подкисление мочи (минеральные воды: нарзан, арзни, дзау-суар и др.; препараты: цистенал, аскорбиновая кислота, метионин). Назначается диета с ограничением продуктов, богатых фосфором (сыр, печень, икра, курица, бобовые, шоколад и др.). При выраженной экскреции фосфата кальция необходимо добиться снижения всасывания фосфора и кальция в кишечнике (например, назначением альмагеля). Обязательным компонентом лечения при наличии трипельфосфатов является антибактериальная терапия и санация хронической инфекции мочевой системы [5, 8].
Лечение цистиноза и цистинурии включает диету, высокожидкостный режим и медикаментозную терапию, направленную на подщелачивание мочи и повышение растворимости цистина [4, 5, 6, 8, 9].
Цель диетотерапии — предотвратить избыточное поступление в организм ребенка предшественника цистина — метионина и других серосодержащих кислот. Для этого также исключают (или резко ограничивают) из рациона питания ребенка богатые метионином и серосодержащими аминокислотами продукты — творог, рыбу, яйца, мясо и др. Поступление метионина при таких диетических мероприятиях сокращается до 0,7 г/сут. Поскольку метионин необходим растущему организму ребенка для пластических процессов, длительное применение строгой диеты невозможно, поэтому через 4 нед от начала диетотерапии рацион ребенка расширяется и приближается к обычному, но характеризуется строгим исключением рыбы, творога и яиц.
Количество жидкости, употребляемой ребенком, должно быть не менее 2 л/сут, особенно важно принимать жидкость перед сном. Для подщелачивания мочи используется цитратная смесь, растворы гидрокарбоната натрия, блемарен, щелочные минеральные воды. Это позволяет добиться повышения рН мочи до 7,5–8,0. Снижению концентрации цистина и повышению рН мочи будут также способствовать ингибиторы карбоангидразы (диакарб) и гипотиазид.
Для повышения растворимости цистина и предупреждения кристаллизации назначается пеницилламин, с целью активации тиолзависимых ферментов. Пеницилламин обладает некоторой токсичностью и антиметаболическим действием на пиридоксин, поэтому в начале терапии назначаются невысокие дозы препарата — 10 мг/кг/сут в 4–5 приемов, далее доза увеличивается в течение недели до 30 мг/кг/сут, а при цистинозе — до 50 мг/кг/сут. Лечение пеницилламином должно проводиться под контролем содержания цистина в лейкоцитах и/или цианиднитропруссидного теста (проба на цистин в моче, где концентрация цистина должна составлять до 150–200 мг/л). При достижении этих показателей доза пеницилламина снижается до 10–12 мг/кг/сут. Лечение пеницилламином проводится длительно, годами. Поскольку пеницилламин инактивирует пиридоксин, параллельно назначается витамин В6 (пиридоксин) в дозе 1–3 мг/кг/сут в течение 2–3 мес с повторными курсами. Для стабилизации мембран почечных канальцев назначаются витамин А (6600 МЕ/сут) и витамин Е (токоферол, 1 капля на 1 год жизни 5% раствора в сутки) в течение 4–5 нед с повторными курсами. Имеются данные о положительном эффекте применения вместо пеницилламина менее токсичного его аналога — купренила в уменьшенной дозе в сочетании с ксидифоном и другими мембраностабилизаторами [4, 5].
Антибактериальная терапия показана при присоединении инфекции.
При цистинозе успешно используется трансплантация почки, которая проводится до развития терминальной стадии хронической почечной недостаточности (ХПН). Трансплантация почки позволяет значительно увеличить срок жизни больных — до 15–19 лет, однако отложение кристаллов цистина наблюдается и в трансплантате с преимущественным поражением интерстиция и мезангиума, что в конечном итоге приводит к развитию интерстициального фиброза и склерозированию в пересаженной почке и ХПН.
Прогноз при вторичной ДН в целом благоприятен. В большинстве случаев при соответствующем режиме, диете и медикаментозной терапии удается добиться стойкой нормализации соответствующих показателей в моче. В отсутствие лечения или при его неэффективности наиболее естественными исходами ДН являются МКБ и ТИН.
Самым частым осложнением ДН является развитие инфекции мочевой системы, в первую очередь пиелонефрита. Среди 126 детей с ДН, наблюдавшихся в отделении нефрологии РДКБ в 2004 г., у 66 ДН сочеталась с пиелонефритом. Однако следует отметить, что при выявлении ДН на фоне пиелонефрита невозможно достоверно установить первичной или вторичной по отношению к пиелонефриту является ДН. Все случаи цистинурии были выявлены только у больных с пиелонефритом.
Динамическое наблюдение детей с ДН осуществляется врачом-нефрологом. При развитии ТИН, МКБ или ХПН на фоне ДН наблюдение продолжается до перевода ребенка во взрослую поликлинику. При формировании инфекционно-воспалительных осложнений почек за ребенком ведется наблюдение как при вторичном пиелонефрите.
Диспансерное наблюдение детей с ДН (по М. В. Эрману, 1997; с изменениями) [8] предполагает следующее.
Особое внимание при этом обращают на общее состояние, артериальное давление, мочевой синдром (кристаллурия, лейкоцитурия, эритроцитурия, протеинурия). Дополнительные методы обследования: анализы мочи 1 раз в 1–2 мес; количественные пробы (по Нечипоренко или Аддису–Каковскому) — 1 раз в 3–6 мес; биохимическое исследование мочи и АКОСМ — 1 раз в 3 мес; проба Зимницкого — 1 раз в год; УЗИ почек, мочевого пузыря — 1 раз в 6–12 мес.
Основные пути оздоровления:
Критерии эффективности диспансеризации:
Литература
А. В. Малкоч, кандидат медицинских наук
В. А. Гаврилова, доктор медицинских наук
РГМУ, РДКБ, Москва