уратурия что это такое у взрослых
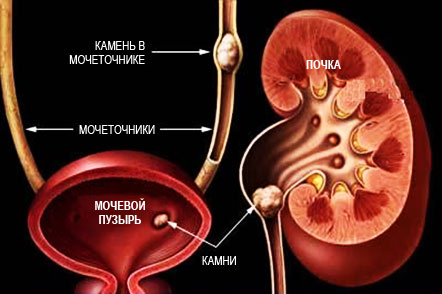
Мочекаменная болезнь
Мочекаменная болезнь стала бичом современных людей. Изменившееся питание, питьевая вода, содержание витаминов и ферментов, нарушенный гормональный статус привели к тому, что в мочевыделительной системе стали образовываться твердые солевые частицы, которые могут соединяться в крупные конкременты “камни”. Такие явления наблюдаются и у мужчин, и у женщин в одинаковой степени. Образования могут находиться в почках, мочевом пузыре, мочеточниках, а также в мочеиспускательном канале.
Симптомы
Образование камней происходит незаметно и болезнь проявляет себя лишь, когда они начинают мешать выводу мочи, во время движения камней по системе. В этот момент возникает сильнейшая боль — почечная колика, которую многие считают одной из самых чувствительных, она может сопровождаться тошнотой, рвотой. До острого периода мочекаменная болезнь дает о себе знать болевыми ощущениями в пояснице, паху, частыми позывами к мочеиспусканию и резями при опорожнении мочевого пузыря, появлением крови в моче.
Все эти признаки для мужчин и женщин очень мучительны, при самостоятельном определении причины боли, как правило люди чаще все сосредотачивают внимание на ощущения в спине и теряют время, обращаясь не к тем врачам.
К урологу на прием в большинстве, пациенты записываются при появлении крови в моче. В острый период может подняться температура.
В нашей клинике для выявления мочекаменной болезни назначаются анализы на содержание солей в моче и УЗИ (Ростов-на-Дону).
В результате исследований определяются: размеры конкрементов и их химический состав и место расположения. Камни могут быть из нерастворимых солей: уратов, фосфатов и оксалатов
Мочекаменная болезнь — лечение
Лечение мочекаменной болезни зависит от размера камня, его состава и где он находится. Самая главная ошибка пациентов заключается в желании раздробить камень на мелкие частицы и ожидать, что они выйдут с мочой без наблюдения врача, народными методами.
Если конкремент большой, то его дробление должно происходить только под присмотром врача и в условиях стационара. Все дело в том, что может произойти закупорка каналов и возникает риск воспаления (карбункул или абсцесс) или же начаться атрофический процесс (гидронефроз), что впоследствии приводит к угрозе жизни и чаще всего удалению почки.
Врач определяет какой вид лечения необходим. В настоящее время разработаны эффективные методики, позволяющие удалить камни с минимальным ущербом для организма:
В программе лечения и мероприятия, направленные против повторного образования камней.
Что нельзя делать при мочекаменной болезни
Образование камней у каждого человека происходит по-разному. У одних, образовавшись однажды, они остаются надолго в том же объеме, у других процесс стремительный. Поэтому есть несколько правил, которые помогут уменьшить риск развития болезни и негативных последствий.
Повлиять на многие факторы сложно, но на диету — вполне.
Если уже диагностирована мочекаменная болезнь важно учесть химический состав камней.
Камни из оксалатов — содержат соли щавелевой кислоты. С целью снижения процесса их образования следует ограничивать шоколад и продукты содержащие какао, кофе, крепкий чай, молочные и кисломолочные продукты, бобовые.
Камни из уратов — содержат соли мочевой кислоты. Необходимо исключить из рациона субпродукты — почки, печень, мозги, почки, снизить употребление мяса, особенно красного, кофе, жареные и острые продукты, алкоголь.
Если конкременты большие или много крупных элементов, то стимулирование мочеотделения может привести к закупорке протоков, поэтому рекомендовано не увеличивать объем жидкости. Необходимо с лечащим врачом обсудить свой рацион и совместными усилиями обрести здоровье.
Гераци — медицинский центр в Ростове-на-Дону, где работают опытные урологи и специалисты УЗИ с ученой степенью, которые помогут четко и правильно провести диагностические мероприятия и выработать эффективный план лечения.
Стоимость на услуги медицинского центра можно посмотреть в разделе “Прайс” или обратившись по телефону круглосуточной горячей линии +7 (863) 333-20-11.tel:+7 (863) 333-20-11.
Подагра: причины, симптомы, диагностика, лечение
Подагра – системное заболевание, характеризующееся нарушением обмена пуринов в организме и отложением кристаллов урата в суставах. Основным проявлением расстройства считаются повторяющиеся приступы артрита с интенсивной болью в суставах и возникновением тофусов – подагрических узелков. Также при этом заболевании возможно накопление солей в почках с развитием мочекаменной болезни и почечной недостаточности.
Распространенность заболевания среди взрослого населения в Европе составляет от 0,9 до 2,5%, а в США достигает 3,9%. Наиболее часто подагру выявляют у мужчин старше 40 лет. Среди женщин патология встречается в 6-7 раз реже.
Причины подагры
Подагра также известна как «болезнь пирующих королей». Такое название она получила из-за того, что основным источником ее возникновения считалась неумеренность в еде и спиртных напитках.
У женщин подагра развивается обычно в постменопаузу, поэтому прослеживается связь заболевания также и с гормональными изменениями в организме.
Симптомы подагры
Первым клиническим проявлениям патологии может предшествовать длительный бессимптомный период гиперурикемии, когда нарушения выявляются лишь при лабораторном исследовании крови.
Первые приступы боли возникают внезапно, преимущественно ранним утром или ночью, склонны нарастать в первый день и полностью проходят за несколько часов или в течение суток. Во время обострения подагры могут также присутствовать признаки интоксикации – повышение температуры тела, озноб, слабость. После стихания воспаления подагрический артрит возникает вновь, как правило, в срок от полугода до двух лет. По мере прогрессирования заболевания продолжительность периодов его бессимптомного течения сокращается, суставные боли возникают все чаще и переносятся тяжелее.
При переходе в хроническую форму подагрический артрит сопровождается деформацией и ограничением движений в суставах, боль разной интенсивности приобретает постоянный характер. В дальнейшем отложения кристаллов мочевой кислоты становятся видимыми. Под кожей, чаще в области суставов, появляются тофусы – узелки белого или желтого цвета с крошковидным, творожистым содержимым. Над ними возможно образование язв, гнойных ран.
Гиперурикемия сопровождается частыми обострениями сопутствующих заболеваний – ишемической болезни, сахарного диабета, артериальной гипертензии, атеросклероза. В случае развития осложнений подагры присоединяются свойственные им симптомы. Для мочекаменной болезни это тянущая боль в пояснице, периодическое появление крови в моче, учащенное мочеиспускание в ночное время. При продолжительном течении хронической тофусной подагры суставной хрящ разрушается, ограничение подвижности сустава сохраняется вне периодов обострения, возможно полное заращение суставной щели с формированием анкилоза (полной неподвижности сустава). Последствием постоянного болевого синдрома может быть также депрессия.
Диагностика подагры
Рентгенография в начале заболевания проводится с целью дифференциальной диагностики с другими артропатиями, специфические же признаки подагры при этом отсутствуют. Только при переходе патологии в хроническую форму на снимках можно увидеть внутрикостные тофусы, краевые эрозии костей.
Ультразвуковое исследование суставов до развития хронической подагры результативно только во время обострений.
МРТ позволяет обнаружить тофусы внутри суставов еще до их появления под кожей, благодаря чему удается раньше начать специфическую терапию гиперурикемии. Метод применяется в дифференциальной диагностике с другими заболеваниями, а также для контроля эффективности лечения. КТ в сравнении с прочими способами визуализации позволяет более точно дифференцировать тофусные массы.
Лечение подагры
Эндогенные пурины повышаются при употреблении большого количества белка животного происхождения, поэтому его суточной нормой для больного подагрой считается не более 1,5 г на 1 кг веса тела пациента. Молочные же продукты с невысокой жирностью, такие как кефир, творог, простокваша, способствуют выведению мочевой кислоты из организма. Сходным действием обладают полиненасыщенные жирные кислоты, например, в составе оливкового масла. Также при подагре необходимо соблюдать питьевой режим – не менее 2,5 литров воды в сутки.
Препаратом выбора для этого считается Аллопуринол. При его непереносимости возможно применение селективного ингибитора ксантиноксидазы – фебуксостата. Умеренное урикозурическое действие оказывают также Лозартан, Амлодипин и Фенофибрат. Диуретики используются с большой осторожностью, только по жизненным показаниям. Хирургическое удаление тофусов проводится лишь при появлении тяжелых осложнений, например, туннельного синдрома, спинномозговой компрессии.
Ураты в моче
Ураты в моче – это важнейший сигнал о том, что в организме человека находятся соли мочевой кислоты. А это происходит только в том случае, когда нарушен обмен веществ, провоцирующий в свою очередь изменение химического состава мочи и нарушения в водно-солевом обмене.
Заметить ураты невооруженным взглядом невозможно, но если это явление вовремя не обнаружить, то существенно возрастает риск развития мочекаменной болезни.
Причины появления уратов
Более распространенное название этого заболевания – уратурия или мочекислый диатез. Появляются ураты при чрезмерном употреблении продуктов, содержащих белки и пуриновые основания. Активное употребление алкоголя тоже провоцирует образование в моче солей уратов.
Провоцирующими факторами, которые увеличивают вероятность возникновения этого заболевания являются: перенесенный пиелонефрит, панкреатит, гепатит и наследственная предрасположенность.
Существует установленный ряд продуктов, провоцирующих мочекислый диатез:
Не нужно полностью отказываться от употребления этого списка продуктов, просто их количество должно соответствовать норме.
Уратурия это заболевание, которому подвержены не только взрослые, но и дети. Появляется эта патология в результате нескольких причин:
Во время беременности, когда у женщины активно проявляется токсикоз, сопровождающийся рвотой и отсутствием аппетита, происходит обезвоживание организма, и в моче могут появляться ураты. Если это явление сохраняется на протяжении длительного времени, необходимо пройти обследование у врача, чтобы скорректировать диету и получить щадящее лечение.
При беременности ураты в моче могут проявляться и при отсутствии токсикоза, это объясняется:
Симптомы
На начальной стадии заболевания, когда движения камней из почек в мочеполовую систему еще нет, симптоматика практически не проявляется.
Диагностика уратов
При диагностировании этого заболевания назначается общий анализ мочи и УЗИ почек.
Лечение уратов
Основное направление лечения этого заболевания – нормализация питания. Необходимо строго придерживаться диеты, которая предусматривает ограничение или полный отказ от употребления мяса. Ежедневное количество белка, которое должно поступать в организм больного составляет не более 1 грамма на 1 килограмм его веса. В рационе должны быть продукты с большим количеством щелочных металлов, кальция, калия и витаминов.
Больному прописывается применение травяных отваров и сборов. Их прием рассчитан на несколько недель, после чего происходит небольшой перерыв и снова цикл приема. Прием специальных травяных сборов не только растворяет, но и выводит соли из организма.
Нарушения минерального обмена в почках (дисметаболические нефропатии)
Содержание
В зависимости от причины развития выделяют первичные и вторичные НМО.
Первичные нарушения представляют собой наследственно обусловленные формы заболеваний, характеризующихся прогрессирующим течением, ранним развитием мочекаменной болезни (МКБ) и хронической почечной недостаточности (ХПН). Первичные дисметаболические нефропатии встречаются редко и начало клинических проявлений развивается уже в детском возрасте.
Вторичные дисметаболические нефропатии могут быть связаны с повышенным поступлением определенных веществ в организм, нарушением их метаболизма в связи с поражением других органов и систем (например, желудочно-кишечного тракта), применением ряда лекарственных средств и др.
Оскалатно-кальциевая нефропатия
Оксалатно-кальциевая нефропатия наиболее часто встречается в детском возрасте. Ее возникновение может быть связано с нарушением обмена кальция или оксалатов (солей щавелевой кислоты).
Причины образования оксалатов:
Оксалатная нефропатия представляет собой многофакторный патологический процесс. Наследственная предрасположенность к развитию оксалатной нефропатии встречается в 70–75%. Помимо генетических, большую роль играют такие внешние факторы, как: питание, стресс, экологические проблемы и др.
Первые проявления болезни могут развиться в любом возрасте, даже в период новорожденности. Чаще всего они выявляются в 5–7 лет в виде обнаружения кристаллов оксалатов, небольшим содержанием белка, лейкоцитов и эритроцитов в общем анализе мочи. Характерно повышение удельной плотности мочи. Заболевание обостряется в период полового созревания в возрасте 10–14 лет, что, по-видимому, связано с гормональной перестройкой.
Фосфатная нефропатия
Фосфатная нефропатия встречается при заболеваниях, сопровождающихся нарушением фосфорного и кальциевого обмена. Основная причина фосфатурии – хроническая инфекция мочевой системы. Часто фосфатно-кальциевая нефропатия сопровождает оксалатно-кальциевую, но при этом выражена в меньшей степени.
Уратная нефропатия (нарушения обмена мочевой кислоты)
Эта группа обменных нарушений наиболее часто встречается у взрослых. Первичные уратные нефропатииобусловлены наследственными нарушениями обмена мочевой кислоты. Вторичные возникают как осложнениядругих заболеваний (болезней крови и др.), являются следствием применения некоторых препаратов (тиазидовых диуретиков, цитостатиков, салицилатов, циклоспорина А и др.) или нарушения функции канальцев почек и физико-химических свойств мочи (при воспалении почек, например). Кристаллы уратов откладываются в ткани почек – это приводит к развитию воспаления и снижению почечных функций.
Первые признаки заболевания могут выявляться в раннем возрасте, хотя в большинстве случаев наблюдается длительное скрытое течение процесса.
Цистиновая нефропатия
Цистин является продуктом обмена аминокислоты метионина. Можно выделить две основные причины повышения концентрации цистина в моче:
Накопление цистина в клетках происходит в результате генетического дефекта фермента цистинредуктазы. Это нарушение обмена носит системный характер и называется цистинозом. Внутриклеточное и внеклеточное накопление кристаллов цистина выявляется не только в канальцах и интерстиции почки, но и в печени, селезенке, лимфоузлах, костном мозге, клетках периферической крови, нервной и мышечной ткани, других органах. Нарушение обратного всасывания цистина в канальцах почек наблюдается вследствие генетически обусловленного дефекта транспорта через клеточную стенку для аминокислот – цистина, аргинина, лизина и орнитина.
По мере прогрессирования заболевания определяются признаки мочекаменной болезни, а при присоединении инфекции – воспаление почек.
Симптомы НМО
НМО почек, как правило, клинически течет бессимптомно до формирования мочекаменной болезни или пиелонефрита, но в ряде случаев могут проявляться следующими симптомами:
Диагностика НМО
Необходимое комплексное обследование включает лабораторные и инструментальные методы.
Лабораторная диагностика
Инструментальная диагностика
УЗИ органов брюшной полости. Изменения, выявляемые при УЗИ почек, как правило, мало специфичны. Возможно выявление в почке микролитов или «песка» (включений). УЗИ почек, как правило, является неспецифичным методом диагностики, однако в ряде случаев позволяет отследить формирование мелких камней и, таким образом, зафиксировать время возникновения мочекаменной болезни.
Лечение
Рекомендации по питанию являются основой терапии как в детском, так и во взрослом состоянии.
| Вид нефропатии | Запрещенные продукты |
| Оксалатная нефропатия | Мясные блюда, щавель, шпинат, клюква, свекла, морковь, какао, шоколад |
| Уратная нефропатия | Печень, почки, мясные бульоны, горох, фасоль, орехи, какао, алкогольные напитки |
| Фосфатная нефропатия | Сыр, печень, икра, курица, бобовые, шоколад |
| Цистиновая нефропатия | Творог, рыба, яйца, мясо |
Лечение оксалатной нефропатии
Лекарственная терапия включает мембранотропные препараты и антиоксиданты. Лечение должно быть длительным. Применяются витамины группы В, А, Е. Назначаются специальные препараты при кристаллурии. Помимо этого, назначается окись магния, особенно при повышенном содержании оксалатов.
Лечение уратной нефропатии
Для поддержания оптимальной кислотности мочи можно использовать цитратные смеси. При уратной нефропатии важно уменьшить концентрацию мочевой кислоты. Для этого используются средства, снижающие синтез мочевой кислоты.
Лечение фосфатной нефропатии
Назначается диета с ограничением продуктов, богатых фосфором (сыр, печень, икра, курица, бобовые, шоколад и др.).
Лечение при фосфатной нефропатии должно быть направлено на подкисление мочи (минеральные воды – нарзан, арзни, дзау-суар и др.; препараты – цистенал, аскорбиновая кислота, метионин).
При любой степени тяжести заболевания необходимо незамедлительно обратиться к врачу нефрологу или урологу за помощью, так как длительно текущие, в целом обратимые, нарушения обмена при отсутствии лечения могут привести к развитию мочекаменной болезни с последующим оперативным вмешательством и хронической почечной недостаточности. Самолечение не допустимо!
Все виды лекарственной терапии должен назначать и обязательно контролировать врач нефролог или уролог, так как:
На первом этапе лечения составляется план лечения. Лечение любой дисметаболической нефропатии можно свести к четырем основным принципам:
Прием большого количества жидкости является универсальным способом лечения любой дисметаболической нефропатии, так как способствует уменьшению концентрации растворимых веществ в моче.
Одной из целей лечения является увеличение ночного объема мочеиспускания, что достигается приемом жидкости перед сном. Предпочтение следует отдавать простой или минеральной воде.
Диета позволяет в значительной степени снизить солевую нагрузку на почки.
Специфическая терапия должна быть направлена на предупреждение конкретного кристаллообразования, выведение солей, нормализацию обменных процессов.
На втором этапе терапии производится оценка эффективности диеты, проводятся контрольные УЗ-исследования и анализы.
Третий этап лечения осуществляется после достижения стойкой ремиссии. Он представляет собой схему постепенного снижения доз назначенных препаратов до поддерживающих или полной их отмены с сохранением диетических рекомендаций.
Даже после достижения долгожданной ремиссии пациенту рекомендуется быть внимательным к себе и регулярно наблюдаться у врача нефролога или уролога, так как высок риск рецидива заболеваний.
Практически всем пациентам необходимо принимать рекомендованные врачом средства противорецидивной терапии или придерживаться ранее разработанной диеты для предотвращения формирования или прогрессирования МКБ, воспаления почек.
Прогноз
Прогноз при дисметаболической нефропатии в целом благоприятен. В большинстве случаев при соответствующем режиме, диете и лекарственной терапии удается добиться стойкой нормализации соответствующих показателей в моче. В отсутствие лечения или при его неэффективности наиболее естественным исходом дисметаболической нефропатии является мочекаменная болезнь и воспаление почек.
Самым частым осложнением дисметаболической нефропатии является развитие инфекции мочевой системы, в первую очередь пиелонефрита.
Если вы обнаружили у себя какие-либо из перечисленных выше симптомов (нарушение мочеотделения, изменения свойств мочи, боли), необходимо в ближайшее время обратиться к врачу за помощью.
Помните, что очень важно начать лечение на ранних стадиях болезни, так как НМО в почках является преимущественно обратимым состоянием, а в случае отсутвтия лечения итогом является развитие мочекаменной болезни, пиелонефрита.
Рекомендации
Для профилактики развития заболевания, а так же рецидива, необходимо придерживаться правильного, сбалансированного и регулярного питания – избегать острой пищи, маринадов и пр. В период обострения пациентам рекомендуется щадящая диета, соответствующая требованиям биохимического вида нефропатии (оксалатная, уратная и пр.).
С целью профилактики рецидивов всем пациентам рекомендуется один раз в квартал консультация врача нефролога или уролога для необходимой коррекции медикаментозной терапии и пищевых рекомендаций.
Пациенты, длительно страдающие НМО в почках, относятся к группе повышенного риска по МКБ. Поэтому в период ремиссии им необходимо ежегодно проходить по назначению врача контрольные обследования (общий анализ мочи, биохимия мочи, УЗИ почек, мочеточников, мочевого пузыря) мочевыводящей системы.
Часто задаваемые вопросы
Излечимы ли НМО?
НМО часто обусловлено наследственными нарушениями обмена, что требует постоянного соблюдения как минимум диетических рекомендаций.
Из-за чего возникает заболевание?
НМО может быть связано с наследственной предрасположенностью, а также с заболеваниями внутренних органов (желудочно-кишечные проблемы, заболевания крови и пр.), применением определенных групп лекарственных препаратов (мочегонные средства, цитостатики и пр.).
Является ли заболевание противопоказанием к беременности?
Само НМО в почках требует наблюдения весь период беременности с соблюдением диетических рекомендаций.
При развитии МКБ, пиелонефрита и их осложнений в виде ХПН, возможность беременности и ее сохранения зависит от обострения процесса и стадии осложнений и решается в каждом конкретном случае.
Может ли заболевание почек проявляться снижением потенции?
Непосредственно НМО конечно не влияет на потенцию, но в случае развития осложнений МКБ, воспаления почек или развития ХПН снижение потенции может появиться как реакция на хроническое заболевание.
Увеличивается ли риск заболеть, если близкий родственник страдает данным заболеванием?
Да, существует группа первичных обменных нефропатий (НМО в почках), имеющая наследственную предрасположенность.
Гиперурикемия: взгляд кардиолога
 | Я.А. Орлова, д.м.н., заведующая отделом возраст-ассоциированных заболеваний Медицинского научно-образовательного центра ФГБОУ ВО МГУ им. М.В. Ломоносова |
Мочевая кислота была впервые идентифицирована почти двести лет назад, несмотря на это, некоторые патофизиологические аспекты повышения ее уровня в плазме крови до сих пор не совсем понятны. В течение многих лет гиперурикемия ассоциировалась с риском развития подагры и нефролитиаза, теперь же мочевая кислота является предметом пристального изучения как маркер ряда метаболических и гемодинамических нарушений.
По данным эпидемиологических исследований, распространенность гиперурикемии в популяции очень высока – почти 17% взрослого населения России имеют повышенный уровень мочевой кислоты (МК): более 400 мкмоль/л, приблизительно 7 мг/дл – для мужчин, более 360 мкмоль/л, приблизительно 6 мг/дл – для женщин. Люди вообще имеют более высокий уровень МК, чем большинство млекопитающих, из-за дефицита печеночного фермента уриказы и более низкого фракционного выделения МК. Приблизительно две трети общего количества уратов в организме вырабатывается эндогенно, а оставшаяся треть приходится на пурины, поступающие в организм с пищей. Приблизительно 70% вырабатываемых уратов постоянно выводятся почками, а остальные – кишечником. Однако при почечной недостаточности вклад кишечной экскреции уратов увеличивается, чтобы компенсировать снижение их выведения почками. Уровень МК в крови является отражением баланса между расщеплением пуринов и скоростью их выведения из организма. Теоретически, любые изменения в этом балансе могут быть причиной повышения сывороточного уровня МК, но на практике именно нарушение выведения уратов является причиной большинства случаев гиперурикемии.
Увеличение уровня МК в плазме крови прогрессивно повышает риск развития подагры. Однако абсолютный риск не так уж велик. Согласно большим проспективным исследованиям, в течение 15 лет клинически выраженная подагра развилась только у 49% пациентов даже с высоким уровнем гиперурикемии (10 мг/дл и выше). Эти наблюдения указывают на наличие дополнительных факторов в патогенезе подагры; это могут быть ингибиторы или активаторы образования кристаллов уратов в присутствии их повышенных концентраций в тканях, генетические факторы и факторы окружающей среды, которые определяют воспалительный ответ на осажденные уратные кристаллы.
Связь гиперурикемии с риском развития нефролитиаза еще менее линейна. Даже у больных подагрой только в 20–25% случаев имеет место мочекислый уролитиаз. В этом случае очевидно, что на риск развития мочекаменной болезни влияет не только гиперпродукция эндогенной МК и дефект ее почечной экскреции, но и кислотность мочи, а, вероятно, и другие ее характеристики.
Первая публикация о том, что уровень МК в плазме крови может быть связан с сердечно-сосудистыми заболеваниями (ССЗ), появилась в Британском медицинском журнале в 1886 г. К середине XX века было показано, что у пациентов с ишемической болезнью сердца значительно повышен уровень МК по сравнению с группой контроля, сопоставимой по возрасту и полу. Последующие эпидемиологические исследования, включившие в общей сложности около 100 тыс. пациентов, подтвердили роль МК как фактора риска ССЗ. Описано несколько потенциальных механизмов, благодаря которым гиперурикемия может играть роль в патогенезе сердечно-сосудистых событий, но ни один из них пока не имеет надежных доказательств.
Очевидно, что повышенный уровень МК усиливает оксигенацию липопротеидов низкой плотности и связан с увеличенной продукцией свободных кислородных радикалов, что может играть роль в прогрессировании атеросклероза. МК может оказывать влияние на процессы адгезии и агрегации тромбоцитов. Это породило гипотезу о том, что гиперурикемия повышает риск коронарного тромбоза у пациентов с уже имеющимися коронарными заболеваниями. Предполагают, что повышение уровня МК отражает повреждение эндотелия. Эндотелиальная дисфункция, проявляющаяся снижением эндотелийзависимой сосудистой релаксации в результате действия оксида азота, обычна для пациентов с сахарным диабетом и артериальной гипертензией и играет роль в развитии атеросклероза и эректильной дисфункции. Во многих исследованиях обнаружено, что уровень МК связан с гиперлипидемией, в особенности с гипертриглицеридемией. Более сильная связь была выявлена именно с триглицеридами, а не с холестерином, что привело к предположению, о патогенетических механизмах, связывающих гиперурикемию с нарушением углеводного обмена. Гиперинсулинемия, как следствие инсулинорезистентности, может снижать почечную экскрецию МК независимо от клиренса креатинина. Вероятно инсулин, увеличивая канальцевую реабсорбцию натрия, способствует увеличению реабсорбции МК. Длительное время считалось, что гиперурикемия является результатом резистентности к инсулину, а не предшествует ей. В настоящее время на животных моделях показано, что МК сама увеличивает толерантность к инсулину путем ингибирования биодоступности оксида азота, снижая тем самым инсулин-стимулированное усвоение глюкозы. Кроме того, МК может способствовать увеличению риска сахарного диабета прямым цитотоксическим действием на β-клетки поджелудочной железы через аллоксаноподобные производные.
Описывая патогенетические связи гиперурикемии и ССЗ, нельзя обойти почечные механизмы. Повышенный уровень МК, очевидно ассоциирован с почечной сосудистой резистентностью и имеет обратную зависимость от почечного кровотока. Он коррелирует с экскрецией альбуминов с мочой, которые являются предвестниками развития нефросклероза, а нарушение почечной гемодинамики предшествует нарушению метаболизма МК у пациентов с нефропатией.
Таким образом, в настоящее время, несмотря на отсутствие полного понимания причинно-следственных связей, не остается сомнений, что гиперурикемия ассоциирована с повышенными рисками возникновения ССЗ. В Европейских рекомендациях по диагностике и лечению артериальной гипертензии 2018 г. и в Российских рекомендациях, опубликованных на сайте Минздрава в феврале 2020 г., повышение уровня МК (360 мкмоль/л и более у женщин, 420 мкмоль/л и более у мужчин) официально отнесено к факторам сердечно-сосудистого риска. Однако указаний на необходимость использования специфических препаратов для лечения бессимптомной гиперурикемии в Рекомендациях нет. Это связано с отсутствием рандомизированных клинических исследований, подтверждающих пользу терапии. Такой подход полностью согласуется с актуальной позицией других медицинских сообществ. На основании того, что у большинства пациентов с бессимптомной гиперурикемией никогда не развиваются подагра или мочекаменная болезнь, специфическое фармакологическое лечение бессимптомной гиперурикемии не считается полезным или экономически эффективным и, как правило, не рекомендуется. Кроме того, данные последних лет дают основание предполагать, что некоторые из вполне эффективных препаратов для лечения пациентов с гиперурикемией при подагре несут в себе определенный риск. Результаты проспективного исследования CARES, сравнивающего влияние фебуксостата и аллопуринола на ССЗ и их осложнения, показали отсутствие различий по риску развития новых ССЗ между двумя этими группами пациентов, однако сердечно-сосудистая смертность и смертность от всех причин были достоверно ниже в группе пациентов, получавших лечение аллопуринолом. Важно сказать, что исследование имело существенные ограничения, в частности неоднородность при анализе смертности наблюдалась в двух подгруппах у пациентов с сопутствующим приемом аспирина или нестероидных противовоспалительных средств. Кроме того, в отсутствие группы плацебо невозможно с уверенностью определить, представляет ли бóльшая частота сердечно-сосудистой смертности и смертности от всех причин в группе пациентов, получавших фебуксостат, фактическое увеличение подобных событий или, возможно, менее значительное снижение риска их возникновения по сравнению с пациентами, получавшим аллопуринол.
Тем не менее в настоящее время именно аллопуринол считается препаратом выбора для лечения пациентов с ССЗ и гиперурикемией, несмотря на то что результаты исследований с ним достаточно противоречивы. Некоторые из них показывают, что аллопуринол достоверно снижает частоту ССЗ и их осложнений; другие не находят никакой пользы. Неоднородность в дизайне и ограничения, присущие ретроспективным исследованиям, также способствуют этой путанице. Важным прорывом в этом направлении смогут стать результаты продолжающегося проспективного рандомизированного исследования ALL-HEART, в котором изучается влияние аллопуринола на неблагоприятные сердечно-сосудистые исходы у пациентов с установленной ишемической болезнью сердца и бессимптомной гиперурикемией.
Данные о влиянии других препаратов, снижающих уровень МК, на риски возникновения ССЗ и их осложнений крайне ограничены. В одном когортном исследовании Medicare пациенты, принимающие пробенецид, на 20% реже страдали инфарктом миокарда или инсультом, чем пациенты, принимающие аллопуринол. Однако этот результат может отражать базовые различия между группами пациентов – в исследовании отсутствовали важные сравнительные данные, в частности уровни МК до лечения. Кроме того, пациенты, получавшие пробенецид, реже страдали хронической болезнью почек, что также могло повлиять на сердечно-сосудистые исходы.
Однако в настоящее время пациентам с бессимптомной гиперурикемией можно рекомендовать не только изменение образа жизни: коррекцию рациона питания, снижение потребления алкоголя и физические упражнения, которые могут снизить уровень МК. Целый ряд лекарственных препаратов, применяемых в терапевтической практике, показал положительные результаты при гиперурикемии.
Наиболее часто в этом контексте обсуждаются свойства лозартана, блокатора ангиотензиновых рецепторов, широко применяемого при лечении больных артериальной гипертензией и сердечной недостаточностью. Этот препарат достаточно уникален, т.к. вместе со своим неактивным предшественником имеет способность блокировать реабсорбцию секретированной МК в проксимальном канальце почки, значительно снижая уровень МК в плазме крови. Он обладает небольшим моделирующим антиатеросклеротическим действием, улучшает когнитивные функции, позитивно влияет на эректильную функцию. Однако эти свойства в отличие от урикозурического эффекта присущи и другим представителям класса сартанов. По данным некоторых авторов, благоприятное влияние на уровень МК могут оказывать блокаторы кальциевых каналов, в частности исрадипин. В январе 2020 г. опубликованы данные, показавшие, что ингибиторы натриево-глюкозного котранспортера-2 (SGLT-2) могут снизить риск развития подагры у взрослых с сахарным диабетом 2 типа. Глюкозурия, вызываемая этими препаратами, приводит к секреции МК в мочу и снижению уровня МКв сыворотке крови, но ранее связь с подагрой не была показана. В этом новом исследовании наблюдалось снижение относительного риска подагры на 36% среди взрослых, которым назначали ингибиторы SGLT-2, по сравнению с теми, кто получал агонисты рецептора глюкагоноподобного пептида-1 (GLP-1), не влияющие на уровень МК. Полученные результаты показывают, что ингибиторы SGLT-2 могут стать эффективным средством для профилактики подагры у пациентов с сахарным диабетом или нарушениями углеводного обмена. Эффекты лекарств этого класса в снижении сердечно-сосудистой заболеваемости и смертности были ранее продемонстрированы в ряде исследований, однако вклад их урикозурического действия отдельно не изучался.
Таким образом, несколько основных аспектов, связанных с гиперурикемией, являются в настоящее время предметом активного изучения. Во-первых, это дальнейшее исследование роли МК в патогенезе развития ССЗ и нарушений углеводного обмена с выявлением направленности биологических связей. Во-вторых, оценка эффективности и безопасности снижения уровня уратов для модификации рисков ССЗ. Этот вопрос наиболее актуален, когда речь идет о пациентах с бессимптомной гиперурикемией и высоким риском ССЗ. До получения надежных доказательств решение о выборе тактики лекарственного лечения пациентов с ССЗ и гиперурикемией должны приниматься полидисциплинарной врачебной командой.