транспептидаза что это такое
Гамма-глютамилтрансфераза (гамма-глютамилтранспептидаза) катализирует перенос гамма-глютамила на аминокислоту или пептид. ГГТП является мембрано-связанным ферментом.
Изменение активности ГГТП в сыворотке имеет большое диагностическое значение при заболеваниях печени и гепато-билиарного тракта. Этот фермент более чувствителен к нарушениям в клетках печени, чем АЛТ, АСТ, щелочная фосфатаза.
ГГТП многозначна в диагностическом отношении. По крайней мере, 5 процессов служат причиной повышения ее активности в крови:
— некроз печеночных клеток;
— нарушение оттока желчи – холестаз;
— опухолевый рост в печени;
— лекарственные повреждения печени.
Такая этиологическая разновидность механизмов повышения ГГТП требует очень осторожной и тщательной оценки причин этой гиперферментемии. Обнаружение высокой активности ГГТП заставляет искать причину этого повышения. Как «отсеивающий» тест и контроль за течением известного патологического процесса, исследование ГГТП буквально незаменимо по клиническому значению.
Определение активности ГГТП используется для установления факта повреждения печеночных клеток и обычно повыышается в 90% случаев заболеваний печени. В большинстве случаев у таких больных в крови наблюдается повышение активности АЛТ и ГГТП. Изолированное повышение активности ГГТП наблюдается у 6-20% больных с патологией гепато-билиарной системы.
При острых гепатитах активность ГГТП повышается раньше, чем активность АЛТ. На пике заболевания активность ГГТП ниже (повышена в 2-5 раз), чем активность АЛТ, и нормализуется значительно медленнее. Это позволяет использовать ГГТП в качестве контроля выздоровления больного.
Повышение активности ГГТП более чем в 3 раза вызывают антиконвульсантные препараты, жировая дистрофия печени и сердечная недостаточность.
Транспептидаза что это такое
Гамма-глютамилтранспептидаза – фермент (белок) печени и поджелудочной железы, активность которого в крови повышается при заболеваниях печени и злоупотреблении алкоголем.
Гамма-глютаматтранспептидаза, гамма-глютаматтрансфераза, ГГТ, гамма-глутаматтранспептидаза, гамма-глутаматтрансфераза, ГГТП.
Gamma-glutamyl transferase, Gamma-glutamyl transpeptidase, GGTP, Gamma GT, GTP.
Кинетический колориметрический метод.
Ед/л (единица на литр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Желчь образуется в клетках печени и выделяется по системе микротрубочек, которые называются желчными канальцами. Они затем объединяются в печеночные протоки, выходящие за пределы печени, и образуют общий желчный проток, впадающий в тонкий кишечник. Желчь необходима для всасывания жиров, поступающих с пищей. Также через желчь выделяются некоторые лекарственные вещества. Она образуется постоянно, но поступает в кишечник только во время и после приема пищи. Когда она не нужна – накапливается в желчном пузыре.
Гамма-глютамилтранспептидаза – фермент, который находится в клетках печени и желчевыводящих путей и является катализатором определенных биохимический реакций. В кровеносном русле она не содержится, только в клетках, при разрушении которых их содержимое попадает в кровь. В норме часть клеток обновляется, поэтому в крови обнаруживается определенная активность ГГТ. Если гибнет много клеток, ее активность может повышаться значительно.
Тест на ГГТ – самый чувствительный анализ в отношении застоя желчи – холестаза. Активность ГГТ при препятствии оттоку желчи, например при камнях в желчных протоках, повышается раньше, чем активность щелочной фосфатазы. Однако повышение это неспецифично, так как оно происходит при большинстве острых заболеваний печени и желчных ходов, например при остром вирусном гепатите или раке, и обычно такой результат не очень информативен при установлении конкретного заболевания или состояния, вызвавшего повреждение печени.
В отличие от других печеночных ферментов, производство ГГТ «запускается» алкоголем, поэтому у лиц, злоупотребляющих им, ее активность может быть повышена даже при отсутствии заболевания печени. Кроме того, выработка ГГТ стимулируется некоторыми лекарствами, включая фенобарбитал и парацетамол, поэтому на фоне их приема можно ожидать повышения ГГТ без повреждения печени.
ГГТ также содержится в почках, селезенке, поджелудочной железе, головном мозге, простате, и увеличение ее активности неспецифично только для нарушений печени.
Для чего используется исследование?
Когда назначается исследование?
Что означают результаты?
Возраст, пол
Референсные значения
Чаще всего справедливо следующее утверждение: чем выше активность ГГТ, тем тяжелее повреждение печени или желчных ходов.
Причины повышения активности ГГТ
Причины снижения активности ГГТ
Что может влиять на результат?
При патологии костной ткани активность ГГТ, в отличие от щелочной фосфатазы, остается в норме, так же как и при состояниях, связанных с ростом костей, при беременности и почечной недостаточности.
Кто назначает исследование?
Врач общей практики, терапевт, гастроэнтеролог, инфекционист, гематолог, эндокринолог, хирург.
Транспептидаза что это такое
• Большинство бактерий содержат пептидогликан, жесткую внешнюю клеточную стенку, образованную полимерной сеткой гликановых нитей, связанных между собой короткими пептидами
• Пентапептиды дисахаридной природы, являющиеся предшественниками пептидогликана, образуются в цитоплазме, экспортируются из клетки, и собираются вне цитоплазматической мембраны
• Согласно одной из моделей, объясняющей синтез клеточной стенки, мульти белковый комплекс вставляет новый материал, следуя принципу: «прежде чем удалить — сделай»
• Перестройка, модификация и репарация клеточной стенки происходят с участием многих автолитических ферментов
• У некоторых бактерий пептидогликан клеточной стенки играет важную роль в поддержании формы клетки
• Гомолог бактериального актина, MreВ, образует в цитоплазме спиральные филаменты, которые определяют форму клетки, контролируя синтез пептидогликана
У большинства бактерий основной компонент клеточной оболочки называется пептидогликан. Он состоит из сетки гликановых нитей, связанных пептидами. Полимер покрывает всю поверхность микроорганизма, образуя жесткую защитную оболочку. Клеточная стенка, состоящая из пептидогликана, играет критическую роль в обеспечении выживаемости бактерий, поскольку она оказывает сопротивление силе, возникающей за счет высокой внутренней осмолярности клетки, которая действует на цитоплазматическую мембрану.
Поэтому разрыв стенки имеет для клетки катастрофические последствия. Пептидогликан также играет роль в поддержании формы большинства клеток бактерий.
Известные виды бактерий подразеляются на две группы, которые отличаются друг от друга по отношению к прокрашиванию. Различное отношение грамположительных и грамотрицательных бактерий к прокрашиванию по Граму отражает фундаментальные различия в организации их клеточной стенки. У грамотрицательных бактерий присутствует тонкий слой пептидогликана, вероятно, состоящий из одного слоя гликановых нитей.
Поэтому он обладает двухмерной структурой и связующие пептидные мостики располагаются в той же плоскости, что и гликановые цепи. Напротив, у грамположительных бактерий слой пептидогликана гораздо толще и включает несколько слоев гликановых нитей. В этом случае поперечные мостики, вероятно, лежат в разных плоскостях и соединяют нити, находящиеся в одной плоскости с нитями расположенного ниже слоя. Неизвестно, почему у грамположительных и грамотрицательных бактерий сборка пептидогликана происходит столь разными путями. Одно из возможных преимуществ более толстой клеточной стенки заключается в том, что она обладает большей прочностью и поэтому может обеспечивать большую степень защиты от физических воздействий, а также от высокого внутреннего осмотического давления, характерного для грамположительных клеток.
Как показано на рисунке ниже, гликановые нити обычно состоят из повторяющегося дисахарида, N-ацетилглюкозамин-N-ацетилмурамовая кислота (NAG-NAM). Средний размер нитей составляет порядка 30 дисахаридов, однако он варьирует в широких пределах. К NAM ковалентно присоедияется пептид, который синтезируется вне рибосом и включает несколько небычных аминокислот, D-глутаминовую кислоту, D-аланин и диаминопимелиновую кислоту (БАР). (Аминокислоты, используемые для синтеза белка, обязательно должны находиться в L-форме.) DAP служит источником аминогрупп, которые участвуют в образовании сшивок между гликановыми нитями.
Сшивки приводят к высвобождению последнего D-аланина из пептидной цепи. У некоторых бактерий в состав пептидных мостиков входят дополнительные аминокислоты. У грамположительных бактерий нити NAM-NAG. могут соединяться одним или несколькими остатками глицина в пептидных мостиках.
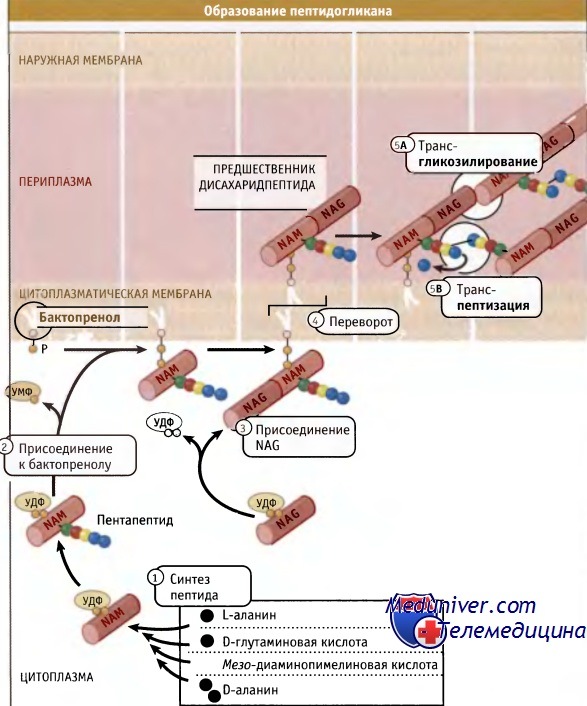
В ходе реакции трансгликозилирования из NAM высвобождается бактопренол (на рисунке не показан).
Как показано на рисунке ниже, дисахаридные предшественники образуются в цитозоле, начиная с уридин-5-дифосфата (УДФ)-NAM. Цепь аминокислот формируется последовательно, и в каждм шаге участвует один фермент. Образующийся пентапептид УДФ-NAM присоединяется к специфическому липиду клеточной мембраны (бактопренолу). Добавление NAG завершает построение дисахаридного предшественника, который затем ориентируется по направлению к внешней стороне мембраны для дальнейшей сборки существующего пептидогликана.
Для включения дисахаридного предшественника в полимер необходимо протекание двух ферментативных реакций: трансгликозилирования для формирования гликановых цепей и транспептидации для образования сшивок. Ферменты, ответственные за транспептидацию, были обнаружены при изучении связывания пенициллина, токсический эффект которого на клетки бактерий связан с его ингибированием транспептидаз. Поэтому они были названы пенициллин-связывающими белками (РВР) Высокомолекулярные белки, относящиеся к классу А РВР, представляют собой бифункциональные ферменты, которые характеризуются наличием отдельного дополнительного трансгликозилазного домена, а также домена, обладающего транспептидазной активностью. У палочковидных бактерий цилиндрическая часть клетки и полукруглые торцы (образовавшиеся при делении), вероятно, требуют специальных машин синтеза пептидогликана.
У Е. coli эти особые транспептидазы представлены белками РВР2 и РВР3 соответственно. Существуют данные, свидетельствующие о том, что эти транспептидазы используют несколько разные субстраты. Так, первая использует боковую цепь пентапептида, а вторая — тетра- или трипептид. Различий в структуре протеогликанов, синтезированных с участием двух этих ферментов, не обнаружено.
Для того чтобы клетка могла расти и делиться, ковалентные связи в пептидогликане должны быть разорваны с тем, чтобы обеспечить включение новых его участков. Существует привлекательная точка зрения, которая объясняет, каким образом обеспечивается безопасное включение новых единиц пептидогликана. Она основана на принципе, которвш можно сформулировать так: «прежде чем удалить — сделай». Иными словами, новые нити добавляются в места образования новых участков до разрыва существующих связей. Как показано на рисунке ниже, процесс в целом контролируется мультиферментным комплексом, который содержит РВР, необходимые для добавления новых участков, и ферменты автолиза, которые затем гидролизуют существующие.
Согласно модели «3 вместо 1», комплекс, содержащий две бифункциональные транспептидазы-трансгликозилазы и специальную гипотетическую трансгликозилазу, образует «тройную упаковку» новых сшитых между собой нитей. Две монофункциональные транспептидазы комплекса связывают новые внешние нити с существующими.
Связывание происходит с любой стороны «матричной» нити. Затем матричная нить гидролизуется ферментом автолиза, который также входит в состав комплекса. Хотя появляются указания на существование ассоциатов, содержащих перечисленные ферменты, остается убедиться в том. что все остальные детали предложенной схемы соответствуют действительной картине. Одна из трудностей, возникающая при попытке проверить эту модель, заключается в том, что для многих бактерий характерна высокая избыточность набора РВР, так что выключение соответствующего гена практически не отражается на фенотипе.

Саккула была получена с использованием агаровой фильтрации.
Однако у большинства бактерий в клеточной стенке содержится множество ферментов автолиза. Эти ферменты действуют на разные связи в пептидогликане. По большей части функции автолизинов неизвестны, за исключением их очевидной роли в деградации клеточной стенки, позволяющей разойтись дочерним клеткам, образовавшимся в конце акта деления. Так же как и в случае РВР, нокаут множественных генов, кодирующих аутолизин, обычно практически не влияет на фенотип, за исключением некоторого утолщения клеточной стенки и задержки разделения клеток.
Существует несколько групп данных, в пользу точки зрения о том, что пептидогликан клеточной стенки играет ключевую роль в поддержании формы бактериальной клетки. Во-первых, как иллюстрирует рисунок ниже, изолированная саккула сохраняет форму клетки, из которой она была получена. Во-вторых, обработка клетки таким ферментом, как лизоцим, который гидролизует стенку, приводит к утрате клеткой своей формы. В-третьих, мутации, приводящие к изменению клеточной формы, часто затрагивают гены, принимающие участие в синтезе клеточной стенки.
На протяжении десятилетий считалось, что бактерии не обладают актиновым цитоскелетом, который определяет форму эукариотических клеток. Однако недавно оказалось, что белок бактерий, MreВ, характеризующийся очень низкой степенью структурной гомологии с актином, фактически является его функциональным гомологом. Действительно, при рентгеноструктурном анализе этого белка обнаружена трехмерная складка, которая совпадает с характерной для актина. Гены mreВ впервые были идентифицированы при исследовании мутантов Е. coli и В. subtilis, у которых отмечалось нарушение клеточных форм. На рисунке ниже показано влияние мутаций в двух отдельных гомологичных генах — mreВ и mbl (близкий к mreВ) на форму клеток В. subtilis.
Ген mreВ найден почти во всех бактериях несферической формы, однако отсутствует у кокков (обладающих круглой формой). Если в качестве исходной принять простую сферическую симметрию круглой формы, то белок MreВ может участвовать в функционировании клеточной системы, обеспечивающей образование более сложных форм: палочковидных (Е. coli и В. subtilis), изогнутых (вибрион) и спирализованных (Helicobacter). На рисунке ниже представлены клетки В. subtilis, экспрессирующие конструкцию, представляющую собой конъюгат кодирующей области белка Mbl и зеленого флуоресцирующего белка (GFP). Белки образуют спирализованные филаментарные структуры непосредственно под клеточной мембраной. Сами по себе эти структуры не обладают достаточной жесткостью, чтобы непосредственно определять форму клетки.
Если искусственно нарушить цилиндрическую форму клетки, например удалив клеточную стенку и приготовив протопласты, Mbl-филаменты утрачивают спиральную конфигурацию. Вероятно, они функционируют, регулируя синтез материала для новой клеточной стенки таким образом, что во время роста, в целом, поддерживаются форма клетки и ее размеры.
Пока окончательно не выяснено, как MreB-филаменты взаимодействуют с клеточной стенкой. Однако гены mreB почти всегда располагаются выше двух других консервативных генов бактерий, mreC и mreD. Оба этих гена также определяют форму клетки и кодируют трансмембранные белки, которые, в принципе, могут сопрягать информацию, получаемую от спирализованных MreB-филаментов внутри клетки, с синтезом клеточной стенки, происходящим вне ее.
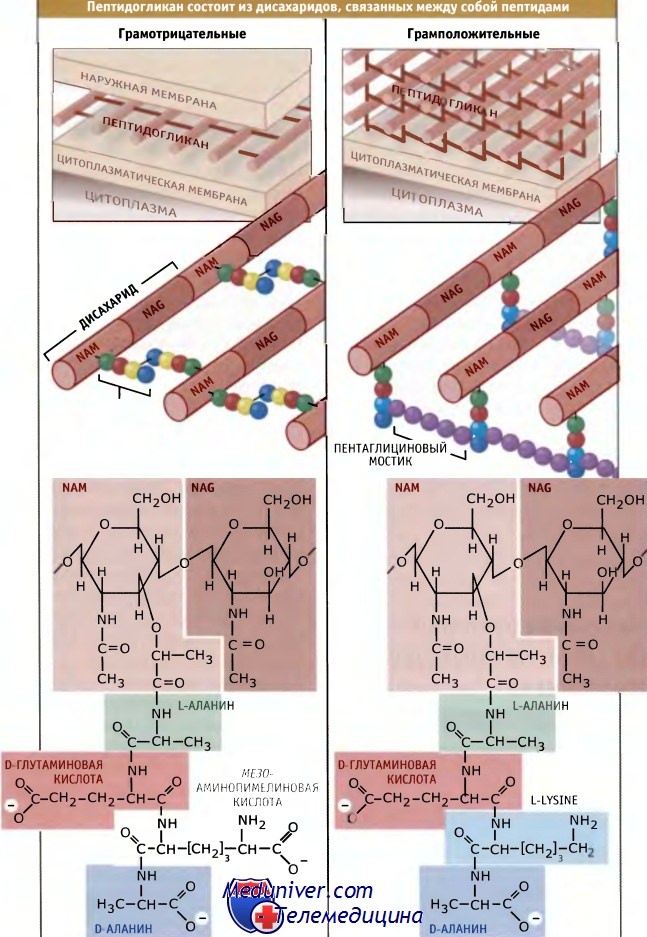
Некоторые грамположительные бактерии вместо мезо-диаминопимелиновой кислоты содержат L-лизин.
Дисахарид представляет собой М-ацетилглюкозамин-М-ацетилмурамовую кислоту (NAG-NAM). 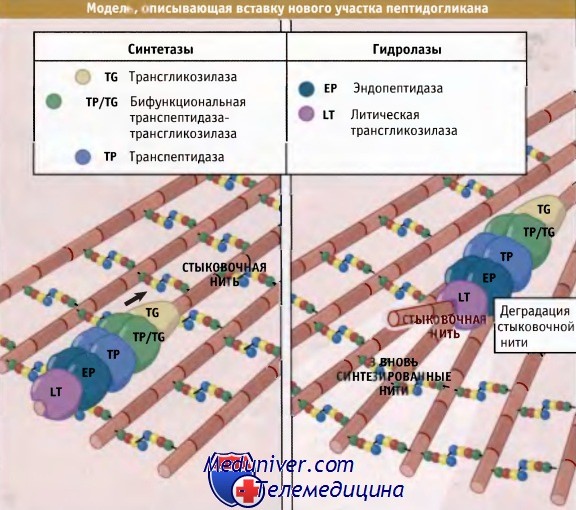
Согласно предложенной модели, мультиферментный комплекс, образующийся на предсуществующей нити (стыковочная нить),
синтезирует три новых сшитых между собой нити и вставляет их в уже имеющийся пептидогликановый слой до момента деградации стыковочной нити. 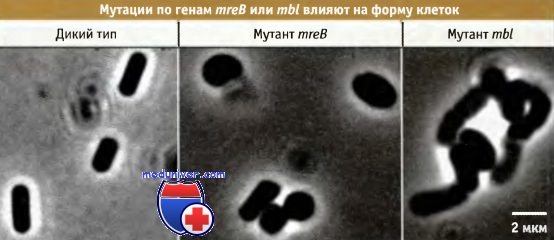
Клетки дикого типа имеют палочковидную форму, mreВ-мутанты, более округленную,
а мутантам по гену mbl свойственна изогнутая форма. 
образует в клетках спирализованные филаментарные структуры.
На фотографии показаны три клетки Bacullus subtilis, экспрессирующие Mbl-GFP.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Транспептидаза что это такое
Синонимы : Gamma-glutamyl transferase, Gamma-glutamyl transpeptidase, GGTP, GTP, GGT, Гамма-глютаматтрансфераза, Гамма-глютаматтранспептидаза, Гамма-глютамилтранспептидаза, Гамма-глютамилтрансфераза
Мы сократили затраты на рекламу и содержание точек забора биоматериала. Поэтому цена на анализы для вас в 2 раза ниже. Мы сделали это, чтобы вы сдавали анализы легко и управляли своим здоровьем
Срок исполнения
Анализ будет готов в течение 1 дня, исключая день забора. Срок может быть увеличен на 1 день в случае необходимости. Вы получите результаты на эл. почту сразу по готовности.
Срок исполнения: 2 дня, исключая субботу и воскресенье (кроме дня взятия биоматериала)
Подготовка к анализу
Не сдавайте анализ крови сразу после рентгенографии, флюорографии, УЗИ, физиопроцедур.
За 24 часа до взятия крови:
От 8 до 14 часов до сдачи крови не принимайте пищу, пейте только чистую негазированную воду.
Перед забором крови
Информация об анализе
Гамма-глютаматтранспептидаза (ГГТП) относится к ферментам печени, почек и поджелудочной железы. Уровень ГГТП является показателем того, что в печени, происходят нежелательные изменения.
Назначения
Повышение концентрации этого фермента происходит при циррозе печени, алкогольном или медикаментозном отравлении, застое желчи при образовании камней или опухолей в желчном пузыре. Также содержание ГГТП является контрольным маркером при лечении заболеваний печени.
Специалист
Назначается терапевтом, гепатологом, гастроэнтерологом.
Важно
Активность ГГТП бывает повышена при ожирении. Также многие лекарства могут повышать или понижать уровень ГГТП.
Метод исследования — Кинетический, колориметрический тест
Материал для исследования — Сыворотка крови
Состав и результаты
Узнайте больше о важных маркерах вашего здоровья:
Интерпретация результатов исследования «ГГТП»
Интерпретация результатов анализов носит информационный характер, не является диагнозом и не заменяет консультации врача. Референсные значения могут отличаться от указанных в зависимости от используемого оборудования, актуальные значения будут указаны на бланке результатов.
Гамма-глутаматтрансфераза
Другие названия: Гамма-глютаматтранспептидаза, гамма-глютаматтрансфераза, ГГТ, гамма-глутаматтранспептидаза, гамма-глутаматтрансфераза, ГГТП, Gamma-glutamyl transferase, Gamma-glutamyl transpeptidase, GGTP, Gamma GT, GTP.
Код услуги для заказа 1051 (Гамма-глутаматтрансфераза) в медицинской лаборатории Синэво.
Общая информация:
Гамма-глутаматтрансфераза (ГГТ) – фермент, участвующий в обмене аминокислот. Больше всего его в почках, печени и желчевыводящих путях, поджелудочной железе, тонком кишечнике. При разрушении или повреждении клеток этих органов он попадает в кровь. В норме часть клеток обновляется, поэтому в крови всегда обнаруживается определенное количество ГГТ.
Наиболее высокая активность ГГТ в крови (в 5–30 раз выше нормы) наблюдается при холестазе – нарушении образования желчи или затруднении её оттока из-за закупорки желчевыводящих путей. Анализ крови на ГГТ вместе с другими ферментами, такими как щелочная фосфатаза, АЛТ и АСТ, используется для диагностики заболеваний печени. Увеличение уровня ГГТ происходит при повреждении клеток печени различными факторами, в том числе, и инфекционными.
У лиц, злоупотребляющих алкоголем, «запускается» образование ГГТ, и ее количество в крови может быть повышено даже при отсутствии заболевания печени. Кроме того, выработка ГГТ стимулируется некоторыми лекарственными препаратами, например, фенобарбиталом и парацетамолом, поэтому на фоне их приема возможно повышение ГГТ без повреждения печени.
Определение ГГТ используется для диагностики заболеваний печени и желчного пузыря, особенно при подозрении на закупорку желчевыводящих протоков; для наблюдения за динамикой течения хронического гепатита, обследования и контроля лечения лиц с хроническим алкоголизмом, при оценке токсичности лекарственных препаратов для печени.
Гамма-глутаматтрансфераза — один из маркеров цитолиза при нарушениях функции печени и желчевыводящих путей.
Показание к назначению:
Метод: ферментативный колориметрический метод
Анализатор: Cobas 6000
Единицы измерения: Ед/л
Материал для исследования: сыворотка венозной крови
Подготовка:
Интерпретация результатов:
Результат лабораторных исследований не является достаточным основанием для постановки диагноза. Интерпретация результатов и постановка диагноза осуществляется только лечащим врачом.
Референтные значения:
Стандартизирован в соответствии с рекомендациями IFCC:
Коэффициент перерасчета: Ед/л х 0,0167 = мkat/л
Возможные причины повышения уровня ГГТ:
Возможные причины понижения уровня ГГТ:
Вещества, влияющие на повышение уровня АЛТ:
Вещества, влияющие на понижение уровня АЛТ:
Где сдать ГГТ
Сдать ГГТ можно в любом пункте Синэво в Минске, Барановичах, Бобруйске, Борисове, Бресте, Витебске, Ганцевичах, Гомеле, Гродно, Жлобине, Лиде, Могилеве, Мозыре, Молодечно, Новогрудке, Новополоцке, Орше, Пинске, Полоцке, Речице, Светлогорске, Слуцке, Сморгони, Солигорске.