торакоскопическая аблация что это такое
Мерцательная аритмия излечимое заболевание сердца
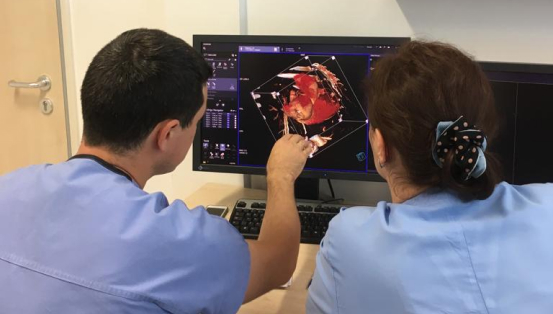
Торакоскопическая аблация– метод лечения сложной формы мерцательной аритмии
Карта России
наших пациентов
Лечение
Малоинвазивные хирургические методы лечения мерцательной аритмии относятся к высокоэффективным и безопасным с минимальным операционным риском. При приступообразной (пароксизмальной) форме и даже если приступ затяжной, но длится менее одного года – в этом случае показано выполнение внутрисердечного РЧА. Операция проводится как под общей анестезией (наркозом), так и под местной анестезией. В этом случае лечебным инструментом является тонкий электрод, который подводят к сердцу через прокол в бедре.
Эффективность лечения таких форм мерцательной аритмии этим способом достигает 65%. Если мерцательная аритмия существует более года и лечащим врачом поставлен диагноз «Постоянная форма мерцательной аритмии» это не значит, что заболевание перешло в неизлечимую фазу.
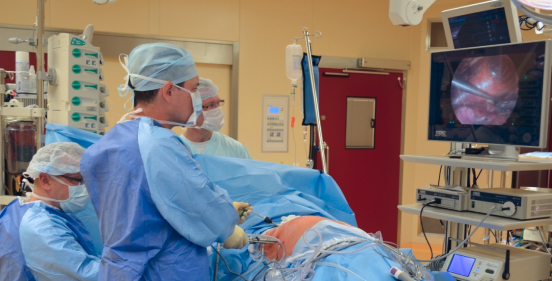
Это значит, что необходимо выполнить оракоскопическую аблацию через три прокола в подмышечных областях. Операция выполняется под общей анестезией и является эндоскопической, хирург контролирует свои действия через камеру.
Для этого метода лечения не важна длительность аритмии, год или 15 лет – эффективность лечения одинакова и составляет около 85%.
Торакоскопическая аблация позволяет снять с человека диагноз «неизлечимая форма мерцательной аритмии» и сразу получить большой шанс на успех.
Операция
Длительность операции торакоскопической аблации 2,5-3 часа.
Торакоскопическая аблация состоит из двух этапов:
1. Нанесение линий высокочастотного воздействия, что приводит прерыванию аритмии и восстановления нормального синусового ритма.
2. Перевязка (исключение) ушка левого предсердия. Выполнение этой процедуры приводит к снижению риска развития ишемического инсульта на 95%.
Нахождение в стационаре
Как правило, предоперационный период длится от одного до 4-5 дней. Всё зависит от исходного состояния и от необходимости дополнительных методов обследования. Перед операцией каждый пациент проходит компьютерную томографию (КТ) сердца. Это исследование даёт точные данные об анатомии и ставит окончательное заключение о наличии или отсутствии тромба в ушке левого предсердия.
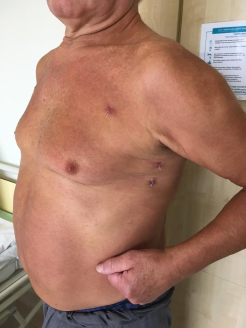
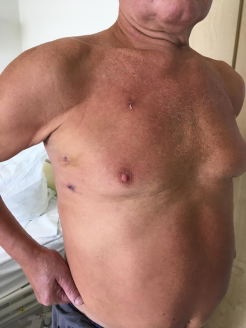
Третьи сутки после операции
Анестезия
Операция выполняется под общей анестезией. Наша команда анестезиологов имеет значительный опыт ведения данного вида операций. После операции пациент переводится в отделение реанимации и интенсивной терапии. На следующее утро лечащий хирург удаляет дренажные трубки поставленные во время операции и осуществляется перевод в профильное отделение.
Активизация и возвращение к обычной жизни
В день перевода из реанимации пациент начинает самостоятельно ходить. Удовлетворительное самочувствие наступает, как правило, на третий день. После операции время нахождения в стационаре составляет 6-10 дней. Обычно, к 15 дню после операции можно вернутся к трудовой деятельности если не требуется большая физическая нагрузка.
Плюсы торакоскопической аблации
Минусы торакоскопической аблации
Кому показана торакоскопическая аблация
Торакоскопическая аблация показана пациентам у которых по данным других обследований сердца необходимо лечить только мерцательную аритмию. Методика эффективна при всех формах фибрилляции предсердий. Если мерцательная аритмия существует много лет – это не противопоказание к методу.
Противопоказания к торакоскопической аблации
Есть абсолютные и относительные противопоказания.
Относительные
Абсолютные
Список обследований перед операцией
Федеральная квота
Для граждан России операции выполняются по федеральной квоте для оформления которой необходимо иметь
Федеральное государственное бюджетное учреждение «Федеральный центр высоких медицинских технологий» Министерства здравоохранения Российской Федерации (г. Калининград).
Торакоскопическая аблация что это такое
В норме регулярная работа нашего сердца поддерживается электрическими импульсами, которые генерируются группой специальных клеток. Эти клетки сформированы в компактное образование – синусовый узел, расположенный в верхней части правого предсердия [рис. 1].
При фибрилляции предсердий (мерцательной аритмии) вместо регулярного сердечного ритма в предсердиях возникают множественные электрические волны, приводящие к хаотичным сокращениям обоих предсердий с очень высокой частотой [рис. 2].
Фибрилляция предсердий (мерцательная аритмия), как правило, проявляется учащенным нерегулярным сердечным ритмом, одышкой, плохой переносимостью физических нагрузок. Нередко фибрилляции предсердий протекает бессимптомно и обнаруживается случайно при регистрации ЭКГ. Нередко у пациентов с фибрилляцией предсердий (мерцательной аритмии) обнаруживается еще один вид нарушений сердечного ритма – трепетание предсердий [ рис.3 ]. Симптомы трепетания предсердий мало отличаются от фибрилляции предсердий. Точная диагностика данных нарушений ритма и определение тактики лечения должны определяется кардиологом-аритмологом.
2. Зачем и как лечить фибрилляцию предсердий?
Лечение фибрилляции предсердий ставит своей целью:
По данным мировой медицинской статистики фибрилляция предсердий (мерцательная аритмия) – самое часто встречающаяся (1-2 % в популяции) нарушение сердечного ритма. У значительной части пациентов (до 40%) ФП носит бессимптомный характер. У этой категории больных медикаментозное антиаритмическое или немедикаментозное лечение (катетерная аблация) ФП, как правило, не проводится. Лечение этих пациентов заключается в контроле частоты сердечного ритма и назначении антикоагулянтов для профилактики тромбоэмболических осложнений. Пациентам, у которых фибрилляция предсердий сопровождается описанными выше симптомами назначают постоянную антиаритмическую терапию, направленную на профилактику рецидивов ФП. Приблизительно у одной трети среди всех больных ФП удается подобрать эффективный антиаритмический препарат или их комбинацию.
У 30% больных с симптомной, плохо переносимой фибрилляцией предсердий не удается подобрать эффективную антиаритмическую терапию, либо прием антиаритмических средств противопоказан, сопровождается развитием побочных эффектов или пациенты не хотят придерживаться тактики длительного консервативного медикаментозного лечения. Этой категории больных в соответствии с современными международными и российскими рекомендациями рекомендуется проведение катетерной аблации.
Следует подчеркнуть, что выбор вариантов лечения в каждом конкретном случае – задача кардиолога-аритмолога с учетом мнения пациента и объективных медицинских данных.
3. Катетерная и хирургическая аблация
В зависимости от формы фибрилляция предсердий (пароксизмальная, персистирующая или постоянная), наличия другой патологии со стороны сердечно-сосудистой системы и сопутствующих заболеваний применяются 3 разновидности катетерной (или хирургической) аблации:
• внутрисердечная катетерная аблация – наиболее широко используемый метод немедикаментозного лечения ФП. Катетерная аблация проводится в условиях рентгеноперационной с использованием управляемых катетеров, перемещаемых в камеры сердца через сосудистые доступы (бедренные и подключичные вены). Цель катетерной аблации радикальное устранение «источников» аритмии в левом и (при трепетании предсердий) правом предсердии. В настоящее время широкое клиническое применение нашли 2 вида катетерной аблации: радиочастотная катетерная аблация и баллонная криоаблация.
• катетерная аблация (деструкция) АВ узла – разновидность внутрисердечной катетерной аблации, которая применяется в тех случаях, когда ФП сопровождается стойко высокой частотой сердечных сокращений при невозможности медикаментозного контроля или радикального устранения ФП. Аблация АВ узла проводится только после имплантации искусственного водителя ритма (кардиостимулятора).
4. Радиочастотная или баллонная криоаблация?
Как это работает?
Видео 1. Баллонная криоаблация
Эффективность и безопасность
Общепринятым определением эффективности катетерной аблации при ФП считается отсутствие любых предсердных аритмий после аблации без применения антиаритмических средств. Контроль за эффективностью осуществляется клинически (самоконтроль пациентов) или с использованием систем длительной регистрации ЭКГ (ХМ ЭКГ или специальные имплантируемые регистраторы сердечного ритма).
Одним из основных факторов, определяющих эффективность катетерных аблаций при ФП является длительность эпизодов фибрилляции. В тех случаях когда приступы аритмии не превышают нескольких часов или дней (т.н. пароксизмальная форма) и, как правило, закачиваются самостоятельно, оперативное лечение максимально эффективно. В сравнительных исследованиях (международное исследование «Fire and Ice») рецидивов ФП в течение первого года не было у 65% больных как после радиочастотной, так и после баллонной криоаблации. При этом, есть наблюдения, что у лиц без сопутствующей кардиальной патологии эффективность баллонной криоаблации может достигать 80-90%.
У пациентов с персистирующей формой ФП, т.е. с аритмией длительностью более 7 дней, а также требующей для восстановления синусового ритма проведения медикаментозной или электрической кардиоверсии, ожидаемая эффективность катетерных аблаций – около 50-60%.
Если после катетерной аблации ФП рецидивирует с прежней частотой и длительностью, оправданным является проведение повторного вмешательства.
Осложнения при катетерной аблации ФП могут проявляться в виде повреждения сосудов в месте пункции, перфорации стенки сердца с развитием тампонады, образование тромбов в полости сердца и тромбоэмболическими осложнениями, термическим повреждением пищевода, развитием пареза диафрагмального нерва и рядом других. Применение современных высокотехнологичных методов контроля во время внутрисердечных вмешательств, достаточный опыт и квалификация врачей позволяет выполнять данные вмешательства эффективно и без значительного риска развития осложнений. Вместе с тем, необходимо четко осознавать, что решение о проведении интервенционного лечения ФП должен принимать врач с достаточным опытом лечения подобной категории больных, объективно учитывая аргументы «за и против».
5. Катетерная аблация ФП в отделе клинической электрофизиологии и рентгенхирургии нарушений ритма
Интервенционная аритмология – одно из основных направлений в научной и клинической работе отдела клинической электрофизиологии с момента его основания в 1990 г. Почти 20 лет насчитывает опыт лечения различных нарушений сердечного ритма с использованием технологии катетерных аблаций.
С 2012 года в отделе был внедрен метод катетерных аблаций при ФП. Сегодня приоритетным методом, используемым в клинической практике отдела клинической электрофизиологии при немедикаментозном лечении ФП является метод баллонной криоаблации. Этот выбор основан на том, что криоаблация при ФП не уступает по эффективности радиочастотной, являясь при этом наиболее безопасным методом интервенционного лечения ФП, что было доказано при анализе многолетнего опыта ведущих мировых центров в лечении ФП.
Специалисты отдела клинической электрофизиологии проводят полноценное предоперационное обследование пациентов, выполняют интервенционное вмешательство и обеспечивают амбулаторное наблюдение за всеми пациентами в течение не менее 1 года после катетерной криоаблации ФП. В тех случаях, когда у пациентов имеются сложные сопутствующие нарушения сердечного ритма применяется комплексное (одномоментное) интервенционное лечение, либо т.н. «гибридная терапия», сочетающая катетерное вмешательство и последующее медикаментозное лечение. В случае рецидива ФП может быть выполнена повторная баллонная криоаблация или радиочастотная катетерная аблация.
Торакоскопическая аблация что это такое
Национальное общество усовершенствования
врачей им. С.П. Боткина
Торакоскопическая аблация в лечении фибрилляции предсердий
Лекция профессора, доктора медицинских наук Турова А.Н. о торакоскопической аблации в лечении фибрилляции предсердий. Видео из программы «Торакоскопическая аблация в лечении фибрилляции предсердий».
График трансляции:
24.06.2015 10:30-11:00 (мск)
Всероссийская Образовательная Интернет-Сессия
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
Торакоскопическая аблация что это такое
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский НИИ патологии кровообращения им. акад. Е.Н. Мешалкина» Минздравсоцразвития России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский НИИ патологии кровообращения им. акад. Е.Н. Мешалкина» Минздравсоцразвития России
Торакоскопический метод в лечении пациентов с фибрилляцией предсердий
Журнал: Кардиология и сердечно-сосудистая хирургия. 2013;6(4): 37-40
Елесин Д. А., Богачев-Прокофьев А. В., Романов А. Б., Лосик Д. В., Байрамова С. А., Шабанов В. В., Покушалов Е. А., Караськов А. М. Торакоскопический метод в лечении пациентов с фибрилляцией предсердий. Кардиология и сердечно-сосудистая хирургия. 2013;6(4):37-40.
Elesin D A, Bogachev-Prokof’ev A V, Romanov A B, Losik D V, Baĭramova S A, Shabanov V V, Pokushalov E A, Karas’kov A M. Thoracoscopic method in treatment of patients with atrial fibrillation. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2013;6(4):37-40.
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский НИИ патологии кровообращения им. акад. Е.Н. Мешалкина» Минздравсоцразвития России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина» Минздрава России
ФГБУ «Новосибирский НИИ патологии кровообращения им. акад. Е.Н. Мешалкина» Минздравсоцразвития России
Классическое вмешательство лабиринт (Maze III) — «золотой стандарт» хирургического лечения больных с клинически проявляющейся рефрактерной к медикаментозной терапии фибрилляцией предсердий (ФП). Несмотря на высокую эффективность, данное вмешательство не получило широкого применения вследствие технической сложности, большой инвазивности и использовании искусственного кровообращения [1].
Менее травматичные вмешательства внедрены в результате расширения знаний о патофизиологии ФП, а также развития аблационных методик и устройств, которые заменяют оригинальную технику разрез—шов.
Триггерная активность из легочных вен (ЛВ) играет важную роль в патофизиологии ФП, особенно при пароксизмальной форме [2]. Последние клинические и экспериментальные исследования также свидетельствуют о важной роли вегетативной нервной системы в индукции и поддержании ФП [3, 4]. R.Wolf и соавт. [5] разработали методику, при которой изоляция ЛВ и радиочастотная аблация (РЧА) ганглионарных сплетений (ГС) левого предсердия (ЛП) выполняется через двусторонний торакотомный доступ. Торакоскопическое вмешательство менее инвазивно, снижает количество периоперационных осложнений и дискомфорт пациента.
В данном исследовании оценивается первый опыт применения торакоскопического вмешательства у пациентов с различными формами ФП в течение 1 года наблюдения.
Материал и методы
С февраля 2011 г. по август 2012 г. торакоскопическое вмешательство было выполнено у 30 пациентов с рефрактерной к медикаментозной терапии ФП с клиническими проявлениями. Критерии включения в исследование: возраст 18—70 лет, пароксизмальная форма ФП после одной или более неэффективной катетерной аблации, персистирующая или длительно персистирующая форма ФП и размер ЛП более 6 см. Критерии исключения: предшествующие «открытые» хирургические вмешательства на сердце и легких, давность ФП более 10 лет и размеры ЛП более 70 см. Все пациенты подписывали добровольное информированное согласие на проведение хирургического вмешательства.
Возраст пациентов составил от 37,9 до 71,8 (57,6±8,6) года. У всех была нормальная фракция выброса левого желудочка и отсутствовала структурная патология сердца. Катетерную аблацию ранее перенесли 8 (26%) пациентов с пароксизмальной формой ФП и 5 (16%) с персистирующей формой ФП. В общей сложности у 8 (26%) пациентов была пароксизмальная форма ФП, у 15 (50%) — персистирующая форма ФП и у 7 (24%) — длительно персистирующая форма ФП. Клиническая характеристика пациентов до операции представлена в табл. 1.
При проведении вмешательства пациент находился в положении лежа на спине. Операцию выполняли под наркозом с интубацией двухпросветной трубкой. Доступ осуществляли с помощью 3 портов с обеих сторон грудной клетки. Два порта устанавливали в четвертое и шестое межреберье по средней подмышечной линии. Третий порт находился на 5 см кпереди от средней подмышечной линии в третьем межреберье. Эндоскоп вводили через порт, расположенный в четвертом межреберье. Оставшиеся два порта использовались для двух торакоскопических инструментов.
С правой стороны грудной клетки перикард открывали на 2—3 см выше диафрагмального нерва, затем его края фиксировали на держалки для оптимального позиционирования аблационного устройства. Перед РЧА трансполярным электродом (AtriCure, Inc., West Chester, Ohio, США) выполняли сверхчастотную стимуляцию (1000 имп/мин) в области устьев ЛВ для определения локализации ГС. Позитивная вагусная реакция расценивалась при асистолии не менее 3 с или замедлении желудочкового ритма более чем на 50% при наличии ФП. Радиочастотное воздействие выполняли в области ГС в течение 20 с трансполярным электродом (AtriCure, Inc., West Chester, Ohio, США). Затем повторно выполняли сверхчастотную стимуляцию в том же положении для подтверждения эффективности РЧА. При необходимости воздействие было повторено при наличии сохраняющегося вагусного ответа. Конечным пунктом данного этапа операции явилось отсутствие вагусного ответа после воздействия при повторной сверхчастотной стимуляции.
Следующим этапом операции осуществляли «тупое» рассечение пространства вокруг ЛВ с последовательным прохождением в поперечный, а затем косой синус полости перикарда. После этого с помощью диссектора (AtriCure Lumitip, Inc., West Chester, Ohio, США) выполняли обход ЛВ с последующей их изоляцией с помощью биполярного зажима (AtriCure, Inc., West Chester, Ohio, США). Изоляцию выполняли не менее 3 раз в области правых и левых ЛВ. Блок входа подтверждался с помощью биполярного картирующего электрода в отсутствие потенциалов в месте воздействия. Блок выхода подтверждался стимуляционно во время синусового ритма. При необходимости производили дополнительную изоляцию ЛВ. Заключительным этапом выполняли создание 2 аблационных линий от правых верхней и нижней ЛВ, по куполу и нижней стенке ЛП достигая левых легочных вен. Аналогичную процедуру осуществляли с левой стороны, за исключением перикарда, который открывали максимально низко под диафрагмальным нервом. Кроме того, связку Маршала рассекали электрокоагулятором (см. рис. 1, на цв. вклейке). 
Сразу после операции всем пациентам был имплантирован подкожный аппарат для длительного мониторирования ритма сердца (ИКМ). По окончании вмешательства пациентов переводили в палату интенсивной терапии под наблюдение.
Больных с долей ФП 0,5% по данным ИКМ) или какой-либо другой предсердной тахиаритмией. Данные ИКМ после выписки из стационара собирали каждые 3 мес в течение всего периода наблюдения.
Период наблюдения составил 12 мес. Все пациенты получали варфарин в течение 3 мес после операции, дальнейшая тактика антикоагулянтной терапии основывалась на результатах тестирования по шкале CHA2DS2VASc. Кроме того, в течение 3 мес пациентам проводили антиаритмическую терапию, и ее отмена основывалась на наличии рецидивов ФП после «слепого» периода.
Статистические расчеты выполняли с использованием программного обеспечения STATA 12&1. Сравнение эффективности лечения проводили с помощью логрангового критерия, что графически выражалось кривыми Каплан—Майера.
Результаты
Во время вмешательства 2 (6,7%) пациентам выполнена срединная стернотомия из-за выраженных плевральных спаек и в связи с кровотечением из правой нижней ЛВ. У остальных 28 (93,3%) пациентов не было никаких осложнений во время операции. Средняя продолжительность вмешательства составила 150,4±28,7 мин. Все пациенты были переведены в общую палату через 10—12 ч после вмешательства и выписаны через 4—9 (6,1±1,8) дней после операции. Результаты анализа раннего послеоперационного периода представлены в табл. 2.
Периоперационная и отдаленная смертность составила 0. Средний период наблюдения составил 12,5±2,2 мес.
В конце периода наблюдения у 22 (73,3%) пациентов не было зарегистрировано ФП или каких-либо других предсердных тахиаритмий (рис. 2). 
Обсуждение
В данном исследовании представлен первый опыт торакоскопической изоляции ЛВ с аблацией ГС при сроке наблюдения 12 мес. Эффективность при всех формах ФП по данным ИКМ составила 73,3%. Результаты исследования продемонстрировали, что торакоскопический подход является и безопасным, и эффективным, несмотря на то что 2 пациентам потребовалась проведение стернотомии вследствие кровотечения. Эти осложнения развились при выполнении данной процедуры у первых 6 пациентов, что можно связать с «периодом обучения». У последующих 24 пациентов осложнения отсутствовали. Кроме того, данная процедура является эффективной, даже у пациентов с длительным анамнезом ФП или ранее неэффективной катетерной аблацией.
Методика изоляции ЛВ и аблации ГС была ранее описана R. Wolf и соавт [5]. Наши результаты сопоставимы с результатами других исследователей, которые применяли эту технику [6, 7]. Данная операция менее эффективна, чем классическая операция Maze III [1], однако торакоскопический подход имеет ряд преимуществ. Вмешательство является малоинвазивным и не требует применения искусственного кровообращения, а также характеризуется меньшей продолжительностью как самой операции, так и нахождением больных в палате интенсивной терапии и пребывания в стационаре. Следует отметить, что все пациенты с неэффективной катетерной аблацией в анамнезе ответили на торакоскопическое вмешательство (ФП по данным ИКМ