тест на hbp положительный что это значит
Маркеры гепатита В (HBeAg, anti-HBcoreM, anti-HBe, Anti-HBcore)
Гепатит В – острое или хроническое заболевание печени, вызываемое вирусом гепатита В (HBV), протекающее в различных клинических вариантах: от бессимптомных форм до злокачественных (цирроз печени, гепатоцеллюлярная карцинома). На долю ГВ приходится около 15% всех регистрируемых в РФ острых гепатитов и не менее 50% хронических.
Схематично строение вирусной частицы гепатита В можно изобразить так:
Рис.1. Структура вируса гепатита В.
Белок внешней оболочки ВГВ является его поверхностным антигеном – HBsAg. HBsAg – это основной маркёр ГВ. При остром гепатите HBsAg может быть выявлен в крови обследуемых уже в инкубационный период в первые 4–6 недель от начала клинического периода. Присутствие HBsAg более 6 мес рассматривается как фактор перехода болезни в хроническую стадию.
Следует отметить, что только часть HBsAg, образующегося при размножении вируса, используется для построения новых вирусных частиц, основное же его количество поступает в кровь инфицированных лиц, где и определяется HBsAg- антиген.
Это четвертый маркер активной репликации вируса наряду с ДНК, HBs Ag и антиHBc –IgM.
Исчезновение HBeAg и быстрое нарастание титра анти-HBе у больного практически исключает угрозу хронизации ГВ. Отсутствие такой динамики и выявление монотонно низких концентраций анти-НВе, наоборот, может свидетельствовать о развитии хронического ГВ с невысокой активностью (HBeAg-негативный хронический ГВ).
анти-HBs определяют для оценки течения инфекционного процесса и благоприятности его исхода. Факт появления анти-HBs рассматривается как надежный критерий развития постинфекционного иммунитета, т.е. выздоровления после гепатита В. Хотя при хроническом гепатите В HBsAg и анти-HBs могут иногда обнаруживаются одновременно.
Период, в который отсутствуют и HBsAg, и анти-HBs, называется фазой серологического «окна». Сроки появления анти-HBs зависят от особенностей иммунологического статуса больного. Продолжительность фазы «окна» чаще составляет 3–4 мес. с колебаниями до года.
Анти-HBs могут сохраняться пожизненно. Анти-HBs обладают протективными (защитными) свойствами. Этот факт лежит в основе вакцинопрофилактики. В настоящее время в качестве вакцины против ГВ, в основном, применяют препараты рекомбинантного HBsAg. Эффективность иммунизации оценивают по концентрации антител к HBsAg у вакцинированных лиц. Согласно данным ВОЗ, общепринятым критерием успешной вакцинации считается концентрация антител, превышающая 10 мМЕ/мл.
При интегративной фазе развития (т.е. когда вирусные частицы не подвергаются дальнейшей репликации) геном HBV встраивается в геном гепатоцита. Основную роль играет фрагмент, несущий ген, кодирующий HBs антиген Поэтому при этой фазе идет преимущественное образование HBs Ag и антител к коровскому белку и анти- HBe Ag.
Рис. 2. Динамика серологических маркёров при остром гепатите В.
Тест на hbp положительный что это значит
13 С-уреазный дыхательный тест на определение Helicobacter pylori – методика лабораторной диагностики инфекции, вызванной Helicobacter pylori, основанная на анализе в пробах выдыхаемого воздуха специального реагента, содержание которого изменяется под действием выделяемого бактерией фермента уреазы.
Дыхательный тест с 13С-меченной мочевиной, 13С-УДТ.
The urea breath test (UBT).
Какой биоматериал можно использовать для исследования?
Как правильно подготовиться к исследованию?
Общая информация об исследовании
Helicobacter pylori – грамотрицательная бактерия спиралевидной формы, которая обнаруживается в различных областях желудка и двенадцатиперстной кишки человека. Инфицированность Helicobacter pylori в мире довольно высока (по некоторым данным, не менее 50 % населения Земли), однако у большинства носителей инфекция протекает бессимптомно. Микроорганизм был выделен в 1983 году австралийскими учеными Робином Уорреном и Барри Маршаллом, которые доказали его роль в развитии рецидивирующих язв желудка и хронических гастритов. Позднее появились данные о влиянии Helicobacter pylori на развитие опухолей желудка и MALT-лимфом (лимфомы из лимфоидной ткани слизистой оболочки желудка).
Helicobacter pylori способна выживать в агрессивной кислой среде желудка, в том числе из-за интенсивной продукции специального фермента – уреазы. Уреаза расщепляет мочевину с образованием аммиака, который нейтрализует соляную кислоту желудочного сока и таким образом обеспечивает поддержание комфортного для бактерии уровня кислотности (рН).
Среди диагностических методик определения инфицированности Helicobacter pylori в последнее время всё чаще применяется уреазный дыхательный тест. Это неинвазивное исследование (то есть без фиброгастроскопии и биопсии слизистой желудка), основанное на способности бактерии секретировать уреазу. Основным реагентом в данном тесте является 13 С-мочевина, в которой 12 С-атом углерода заменён на 13 С-изотоп. При наличии в желудке Helicobacter pylori продуцируемая бактерией уреаза расщепляет поступившую в желудок с тестовым раствором 13 С-мочевину на аммиак и 13 С-углекислый газ, который затем всасывается в кровь, попадает в лёгкие и выводится с выдыхаемым воздухом.
Непосредственно перед исследованием пациенту необходимо выпить 200 мл апельсинового или грейпфрутового сока, чтобы замедлить эвакуацию из желудка. Через 5-10 минут производится взятие контрольной пробы воздуха – пациент делает выдох в специальный герметичный пакет, который затем закрывается и маркируется соответствующим образом. Для обеспечения точности теста особенно важно выдыхать последнюю (альвеолярную) часть воздуха. Затем пациенту дают выпить 50 мл раствора мочевины, меченной изотопом углерода 13 С. Это раствор без вкуса и запаха, его прием не сопровождается никакими неприятными ощущениями. Раствор готовится непосредственно перед приемом, его необходимо выпить в течение пяти минут после приготовления. Взрослые выпивают приготовленный раствор полностью (50 мл), а дети от 5 до 12 лет – половину. Затем в течение получаса следует находиться в спокойном состоянии, чтобы на результаты исследования не повлиял углекислый газ, выделяющийся при физической нагрузке. Через 30 минут производится взятие второй пробы воздуха, пакет с которой также герметично закрывается и маркируется. Затем пробы воздуха анализируют на инфракрасном спектрометре для определения изотопного соотношения 13 С/ 12 С. Если пациент инфицирован Helicobacter pylori, то во второй пробе воздуха появится увеличенное количество 13 СО2 по сравнению с его содержанием в первой (контрольной) пробе.
Для чего используется исследование?
Когда назначается исследование?
Первичная неинвазивная диагностика инфекции Helicobacter pylori при заболеваниях желудка и двенадцатиперстной кишки;
контроль эффективности эрадикационной (антихеликобактерной) терапии;
наличие кислотозависимых и ассоциированных с Helicobacter pylori заболеваний в семье (среди совместно проживающих);
при отказе от фиброгастроскопии или невозможности ее проведения;
длительное применение нестероидных противовоспалительных препаратов.
Что означают результаты?
В качестве результата уреазного дыхательного теста указывается разница между определенным у пациента и стандартным изотопным соотношением, измеряемая в тысячных долях – промилле:
При подпороговых значениях от 3‰ до 4‰ возможно бессимптомное носительство Helicobacter pylori, что может потребовать повторного проведения уреазного дыхательного теста или других исследований на хеликобактериоз с учетом совокупности клинических факторов.
Определение ДНК Helicobacter pylori в кале (real-time ПЦР)
Определение антител (IgA и IgG) к Helicobacter pylori (количественно)
Определение антигена Helicobacter pylori в кале
Henry’s Clinical Diagnosis and Management by Laboratory Methods, 23e by Richard A. McPherson MD MSc (Author), Matthew R. Pincus MD PhD (Author). St. Louis, Missouri : Elsevier, 2016. Pages 1139.
Кто назначает исследование?
Гастроэнтеролог, терапевт, педиатр, врач общей практики.
Что такое уреазный тест на хеликобактер?
Хеликобактер пилори – это спиралевидная бактерия, атакующая слизистую ЖКТ. Ее обнаруживают в желудке и двенадцатиперстной кишке. Наличие микроорганизма свидетельствует о высоком риске появления гастрита, язвы и гастродуоденита.
Особенность поведения бактерии заключается в том, что она проникает на слизистую органа, закрепляется посредством жгутиков и производит фермент под названием уреаза. Вокруг скопления бактерий формируется среда с повышенным рН. Это влияет на производство желудком соляной кислоты, гастрина и пепсина, а также ферментов, способных быстро расщеплять оболочку слизистой. Выделяемые вещества начинают разъедать ткани, появляется воспаленный участок, где образуется эрозия и, как следствие, язва.
Уреазный тест показывает склонность бактерии к расщеплению мочевины. Его назначают в следующих случаях:
Как проводят уреазный тест?
Врачи выделяют 2 вида анализа: дыхательный и быстрый. Дыхательный тест предполагает употребление пациентом мочевины, содержащей специальный изотопный маркер. Бактерия разлагает мочевину, образуя аммиак и углекислый газ. Последний втягивается желудком, попадает в легкие и выходит из организма на выдохе. Анализ проводится с применением специализированного оборудования: газового спектрометра или лазера и специального контейнера.
Обследование проводится натощак, последнее питье разрешается за час до анализа. Перед уреазным тестированием врач дает рекомендации, которыми не следует пренебрегать для чистоты полученных результатов.
Проходя тестирование, пациент делает выдох в контейнер, который сразу плотно закрывают. Затем необходимо выпить раствор мочевины и через полчаса повторить выдох. В завершении процедуры рот тщательно ополаскивают.
Быстрый уреазный тест
Альтернативная разновидность обследования предполагает биопсию. Проводя гастроскопию, врач берет пробу тканей слизистой в области пораженного участка. Исследуемый образец помещают в специальную среду с мочевиной и индикатором. Если ткань поражена бактерией, то мочевина расщепится, оставив аммиак и углекислый газ, а среда обретет щелочную характеристику и сменит цвет.
Уреазный тест считается наиболее объективным анализом на наличие бактерии хеликобактер пилори. Он сочетает доступную стоимость, современную методику, скорость предоставления результатов обследования и их точность.
Материал размещен в ознакомительных целях, не является медицинским советом и не может служить заменой консультации у врача.
Стаж работы 18 лет.
Редактор справочника лекарственных средств в издательстве ГЭОТАР.
Автор книги: ТЕРАПИЯ ДЛЯ ФЕЛЬДШЕРОВ. ШПАРГАЛКА ДЛЯ ССУЗов. Издательский центр IPR MEDIA.
Диплом о медицинском образовании: ФВ №655463
Научное расследование. Что показывает ИФА на специфические IgG к пищевым антигенам?
Используемая терминология.
Антиген (англ. antigen от antibody-generator — «производитель антител») — любое вещество, которое организм рассматривает как чужеродное или потенциально опасное и против которого организм обычно начинает вырабатывать собственные антитела (иммунный ответ). Антитела (иммуноглобулины, ИГ, Ig) — белковые соединения плазмы крови, образующиеся в ответ на введение в организм человека бактерий, вирусов, белковых токсинов и других антигенов. Связываясь с активными участками (центрами) бактерий, грибов или вирусов, антитела нейтрализуют выделяемые ими токсические вещества, препятствуют размножению, обеспечивают их разрушение в реакциях фагоцитоза. Гиперчувствительность (hypersensitivity) – повышенная чувствительность организма к определенным веществам — антигенам. Опосредуется специфическими рецепторами или антителами, находящимися в свободном состоянии или связанными с мембранами клеток, участвующих в иммунной защите или иммунном ответе. Может определенное время иметь латентное присутствие и не проявляться клиническими реакциями. Гиперчувствительность связана с количественными характеристиками антигенов, такими как доза (дозозависимость). Чаще гиперчувствительность является основой развития патологических (аномальных) реакций иммунной системы (ИС) на различные антигены. В таком случае гиперчувствительность – это состояние организма, при котором защитные механизмы иммунной системы, направленные на охрану постоянства внутренней среды организма, не справляются с выводом продуктов метаболитов патологических иммунных реакций из организма в условиях включения всех выделительных систем ( почки, легкие, ЖКТ, слюнные железы, кожа).
Гиперчувствительность Тип I — анафилактический тип или немедленный. В иммунном ответе на антиген синтезируются иммуноглобулины класса Е(IgE), они циркулируют в свободном состоянии и далее фиксируются на Fc-рецепторах, расположенных на базофилах, эозинофилах, тучных клетках. Повторные попадания антигена, вызывает его связывание с фиксированными антителами IgE и ответную дегрануляцию клеток с выбросом медиаторов воспаления, прежде всего гистамина.
Пищевая аллергия (food allergy) – проявляется в виде воспалительных реакций по механизмам «гиперчувствительности I типа» иммунной системы на белки или компоненты пищи, опосредованные иммуноглобулинами класса Е (IgE). Гиперчувствительность тип III – иммунокомплексный тип воспалительных реакций. Характеризуется образованием комплексов в составе антиген + специфическое антитело + компонент комплемента в состоянии циркуляции. Антителами выступают специфические иммуноглобулины классов G (IgG), М (IgM), A(IgA). Образующиеся циркулирующие иммунные комплексы должны быть элиминированы из организма с главной целью — выведение антигена. При хронической нагрузке антигенами и при активном их образовании, циркулирующие иммунные комплексы способны фиксироваться на рецепторах эндотелия мелких сосудов и клетках систем элиминации выделительных систем и вызывать воспалительные реакции к разрушенным аутоантигенам (собственным белкам) и структурам организма. Пищевая непереносимость (food intolerance): 1). Патологические реакции, возникающие на пищу или ее ингредиенты в результате генетических факторов и/или нарушения физиологических этапов пищеварения, которые запускают вторичные воспалительные реакции с участием иммунной системы. Вторичные воспалительные реакции (ВВР) развиваются по причинам контроля иммунной системой всех уровней пищеварения с целью обеспечения толерантности к пищевым антигенам. Процессы изменения антигенных характеристик пищевых продуктов нарушают их распознавание ИС на уровне иммунокомпетентных клеток. ВВР сопровождаются изменением соотношения про- и противовоспалительных цитокинов, перестройками регуляторных механизмов, направленных на обеспечение защитных реакций выведения причинных антигенов и восстановление гомеостаза организма. 2). Коммерческий термин, обозначающий суммарный комплекс патологических реакций на пищу, не принимающий во внимание закономерности системного иммунного воспаления. В связи с этим были введены и широко используются различные «тесты на пищевую непереносимость», характерные для определенной фазы взаимодействия пАГ с ИС. Иммуноферментный анализ (ИФА): (англ. Enzyme-Linked Immunosorbent Assay — ELISA) — лабораторный иммунологический метод, в основе которого лежит специфическая реакция «антиген-антитело», а определение образующегося комплекса производится благодаря ферментативной реакции окисления красителя. Чувствительность медицинского теста S1- отражает долю положительных результатов, которые правильно идентифицированы как таковые (иными словами чувствительность диагностического теста показывает вероятность того, что больной субъект будет классифицирован именно как больной), S1 = число больных, классифицируемые как больные/ общее число тестируемых больных.
Специфичность медицинского теста S2 — отражает долю отрицательных результатов, которые правильно идентифицированы как таковые (т.е. вероятность того, что не больные субъекты будут классифицированы именно как не больные), S2 = число здоровых, классифицируемые как здоровые/ общее число здоровых.
Чувствительность метода измерения — характеристика метода в виде наименьшего значения изменения физической величины, начиная с которого может осуществляться её измерение данным средством. Под чувствительностью ИФА понимается та минимальная концентрация определяемого реагента, при которой заметно различие в величине сигнала этой концентрации и образца, заведомо не содержащего определяемого реагента (отрицательный контроль). Эта разница в величине сигналов должна составлять 2 — 3 величины стандартного отклонения (СО) для отрицательного контроля.
Специфичность метода измерения подразумевает безошибочность диагностики именно требуемой физической величины или параметра: если результат ИФА положительный, значит, найдены именно те антитела или антигены, которые предполагались, а не какие-то другие.
Иммунодиетология™ — 1) термин, введенный авторами для обозначения нового направления иммунологии, изучающего различные этапы взаимодействия пищевых антигенов с иммунной системой; 2) зарегистрированный товарный знак (ТМ) компании ООО «Иммунохелс Рус».
Введение.
В конце 20-го века была выдвинута гипотеза, согласно которой при попадании пищи в желудочно-кишечный тракт, пищевые антигены (пАГ) проникают через кишечные стенки (интестинальный барьер) в кровеносную систему и, в ряде случаев, вызывают патологические реакции иммунной системы, которые в свою очередь, могут приводить к состоянию, известному в иммунологии, как состояние «гиперчувствительности» определенного типа. А состояние «гиперчувствительности», когда иммунная система не справляется с выведением из организма продуктов иммунных реакций, с большой вероятностью приводит к хроническим неинфекционным заболеваниям, часто именуемым «болезнями цивилизации». Основополагающая статья на эту тему появилась в России в 2000 г. (Розенталь В.М., Воейков В.Л., Волков А.В., Кондаков С.Э., Новиков К.Н. «Роль подбора индивидуального питания в экологической реабилитации человека». Материалы III-й международной конференции. Москва, МГУ, 24-25 ноября 2000. М.: Изд-во РАМН, 2000. с.243-247).
На протяжении последующих 20 лет учеными разных стран были разработаны тесты, позволяющие в лабораторных условиях «in vitro» регистрировать эффекты взаимодействия пАГ с иммунной системой человека, используя различные маркеры (измеряемые физические параметры) характерные для определенной фазы или типа взаимодействия пАГ с иммунной системой. Наиболее известные в США и Европе: York, ALCAT, NuTron, Cito, Prime, MRT, в России: Гемокод, РОЭ. Сравнительный анализ тестов приведен в работе (Розенштейн М.Ю., Розенштейн А.З., Кондаков С.Э., Черевко Н.А. «Современные лабораторные методы диагностики пищевой непереносимости». Бюллетень сибирской медицины, 2016, том 15, № 16, с. 69–78.).
Наиболее распространенным в клинической практике является York тест, разработанный York Nutrition Laboratories (UK) в 90-х годах прошлого века, или ИФА на специфические иммуноглобулины класса G (IgG) — в английской транскрипции ELISA IgG. Маркером в данном тесте является концентрация сывороточных специфических IgG к конкретному пАГ, измеряемая методом иммуноферментного анализа (ИФА). Впоследствии, многие известные лаборатории мира, вывели на рынок аналогичный тест, но уже под своим именем: Biomerica, Us Biotek, Genova Diagnostic, Meta Metrics, White Plane, Everly Well, Pinner test (США), ImmuPro, Dr. Fooke, R-Biopharm (Германия); Инвитро, Иммунохелс, Вектор Бест, Иммунотек, G-тест, Иммуновет (РФ). Что именно предлагается на рынках можно представить по характеру рекламы: IgG Food Intolerance Test (IgG тест на пищевую непереносимость), IgG Food Allergy Test (IgG тест на пищевую аллергию), IgG Food Sensitivity Test (IgG тест на чувствительность к пище). Заметим, что речь идет об одном и том же тесте ИФА на IgG к пищевым антигенам. При одинаковом маркере, различие только в наборе пАГ на тест- системе и методе обработки данных.
2. Существует ли критерий для корректного построения элиминационных диет на основе данных теста ИФА на IgG к пАГ и чем отличается используемая нами «методика Immunohealth™» от всех остальных тестов?
Задача данного научного расследования — дать врачам и всем заинтересованным читателям физически корректный и грамотный ответ.
Физическая модель ИФА на специфические IgG к пАГ.
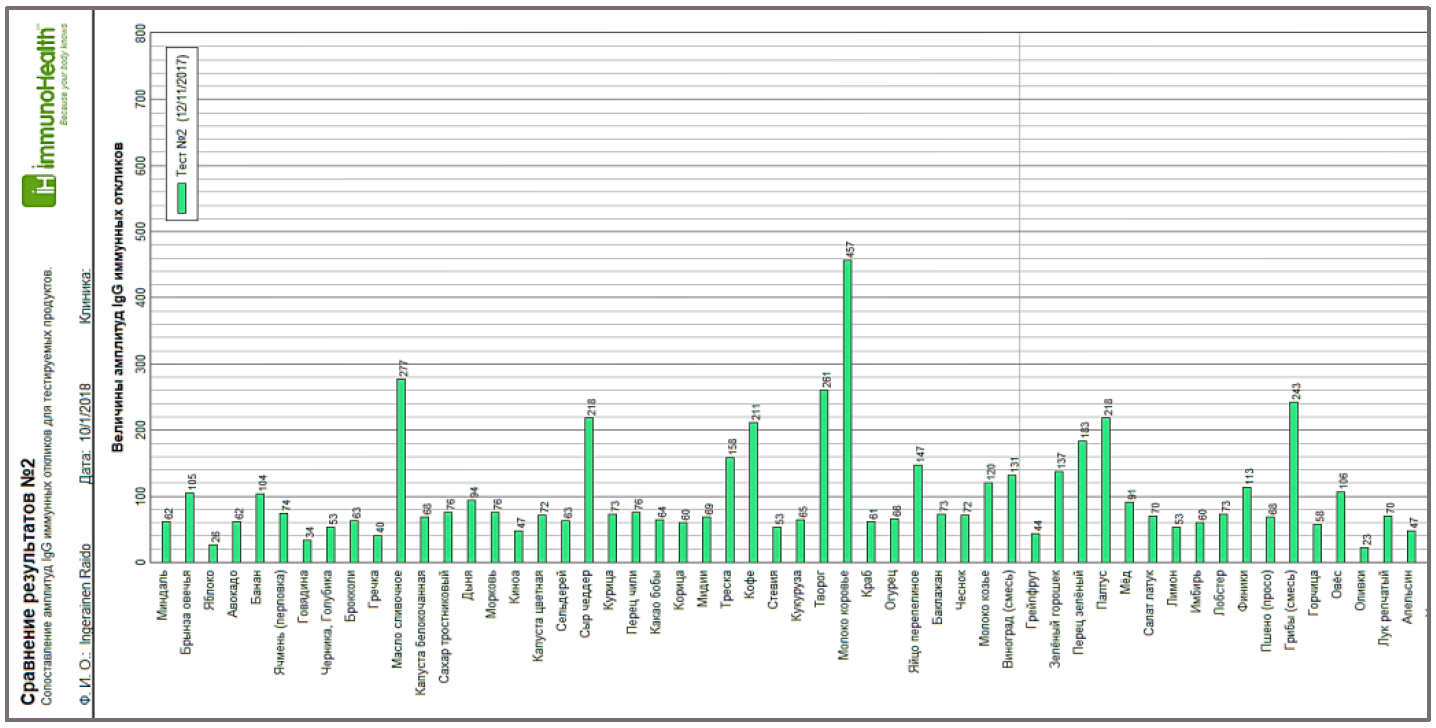
В тесте ИФА на IgG к антигенам из пищевых продуктов последние наносятся на лунки иммунологических плашек ячейки тест- системы для ИФА. В каждую ячейку добавляют равное количество сыворотки крови пациента. В результате взаимодействия специфических сывороточных антител иммунной системы (ИС) с каждым пАГ в образцах сыворотки крови получают порядка 100 иммунных откликов или 100 (для нашего случая) различных величин концентрации Сn(sIgG) специфических IgG. Таким образом, для решения задачи адаптации конкретного индивидуума к пищевой среде проводится эксперимент с его иммунной системой путем смешивания сыворотки крови со статистически представительной выборкой пАГ. Результат подобного тестирования представляет собой 100 значений величин концентраций Сn(sIgG), 1 ≤ n ≤ N, где N=100 — общее число тестируемых пАГ. Как правило, результат тестирования представляется графически в координатах «продукт — амплитуда маркера», Рис 1. Более того, в данной постановке эксперимента совершенно безразлично диагностируем ли мы здорового человека или больного аллергией или иным заболеванием. В том или другом случае, результаты теста ИФА на IgG к пАГ показывают как иммунная система каждого человека взаимодействует с тестируемым набором пищевых антигенов. Т.е. амплитуду IgG иммунных реакций ИС на каждый антиген, что и представлено на Рис 1. На этом лабораторный эксперимент по исследованию взаимодействия пАГ с ИС закончен.
Совершенно очевидно, что ИФА на IgG — диагностический тест, в ходе которого диагностируются процессы взаимодействия специфических иммуноглобулинов (sIgG) c представительной выборкой пАГ. Для описываемого метода ИФА на IgG к пАГ, как метода диагностики иммунных реакций «антиген-антитело» (пАГ-sIgG), характерны следующие оценки: — чувствительность 10−9 – 10−12 моль (вплоть до 10−21 моль в образце); — специфичность – порядка 100% (IgG); — относительная погрешность измерения единичного значения величины концентрации Сn(sIgG) мкг/мл — порядка 3.0-5.0%. Отметим, что медицинские определения «чувствительности S1» и «специфичности-S2», к тесту ИФА на IgG к пАГ, как методу диагностики иммунных реакций «антиген-антитело» (пАГ-sIgG), абсолютно неприменимы. Вывод: никакого отношения эксперимент ИФА на IgG к пАГ к диагностике «пищевой аллергии» не имеет и в этом отношении авторы солидарны с многочисленными критиками. Представьте себе мысленно физический эксперимент из школьного курса физики, аналогичный тому, что мы видим в случае ИФА на IgG к пАГ. Организм – «черный ящик» и мы по косвенным данным (однотипным откликам) должны что-то сказать о состоянии данного «ящика». Предположим, у Вас есть 100 одинаковых по размеру, но из различного материала шаров и Вы решили на расстоянии протестировать этими шарами стену дома, материал и форма которой Вам неизвестны (Рис 2).
Рис 2. Эксперимент по отражению шаров от объекта (стенки).
Вы бросаете перпендикулярно к стенке в локальную область один за другим все шары, они отскакивают от стены под разными углами и на разные расстояния, и на этом эксперимент по взаимодействию шаров со стенкой завершен. Дальнейшие ваши действия уже определяются задачей, поставленной вами перед началом эксперимента. Вас могут интересовать углы отскока, или распределение количества шаров по углам отражения, или длина отскока от стенки в зависимости от материала шаров и т.д. Эти задачи решаются методами, не имеющими отношения к самому эксперименту, только к набору данных по результатам эксперимента.
Вывод: Определение пищевой аллергии методом ИФА на IgG к пАГ является некорректно поставленной задачей тестирования.
Цель теста ИФА на IgG к пАГ.
C точки зрения прикладных задач диетологии, конечным результатом теста ИФА на IgG к пАГ, является не весь набор из 100 значений величин концентраций Сn (sIgG), найденных экспериментально (Рис 1), а только некоторая его часть, которая образована пАГ-антагонистами (пАГ–А), вызывающими патологические реакции ИС, потенциально приводящие к ситуации «гиперчувствительности Тип III» организма индивидуума. Таким образом: основной задачей и конечной целью тестирования реакций «пАГ- sIgG» на основе теста ИФА на IgG к пАГ является исключительно идентификация персонифицированных патологических иммунокомплексных реакций и соответствующих пАГ-А, инициирующих данные реакции. Именно на исключении из рациона пациента пАГ-А, найденных по результатам теста и основывается персонифицированная элиминационная диета: (Розенштейн М.Ю., Розенштейн А.З., Кондаков С.Э., Черевко Н.А. Новый методологический подход к созданию персонифицированной элиминационной диеты при пищевой непереносимости, обусловленной иммунопатологическими реакциями III типа. Бюллетень сибирской медицины, 2015, том 14, № 4, с. 60–67). Встает закономерный вопрос: а как идентифицировать именно патологические реакции по результатам многокомпонентного теста ИФА на IgG к пАГ? (многокомпонентность вызывается тем фактором, что мы проводим единичный ИФА на IgG в каждой n-й ячейке (1 ≤ n≤ N, где N — количество тестируемых пАГ) иммунологической панели. В дальнейшем мы будем использовать более краткую запись многокомпонентного теста ИФА на IgG к пАГ в виде (ELISA IgG)n.
В аллергологии вопрос идентификации патологических иммунных реакций, опосредованных иммуноглобулинами класса Е (IgE), приводящих к «гиперчувствительности Тип I» (аллергические реакции), решается путем экспериментального определения «референтных интервалов» и соответствующих критериев «норма — патология» (“cut-off” criterion), статистически достоверно связанных с наблюдаемой клинической картиной. При этом, основой идентификации реакций «гиперчувствительности Тип I» и инициирующих АГ по результатам теста ИФА на IgE (ELISA IgЕ)n, является только величина титра, или величина концентрации специфических иммуноглобулинов класса Е (IgE) к определенному аллергену (в том числе пАГ).
В отличие от аллергических реакций, опосредованных иммуноглобулинами класса Е (IgE), для иммунокомплексных реакций «пАГ-sIgG», корректное введение «референтных интервалов» и критериев «норма-патология» (в «аллергологическом смысле») принципиально невозможно, поскольку не известны значения концентраций специфических антител класса G к пАГ, при превышении которых наступает клиническая (патологическая) реакция на данный пАГ. Известны только «референтные интервалы» для концентраций общего IgG в крови (стандарт ВОЗ — WHO 67/69).
Несмотря на принципиальные отличия в биохимических свойствах иммуноглобулинов класса E и G, для идентификации патологических иммунокомплексных реакций «пАГ-sIgG», каждая лаборатория, по образу и подобию с анализом на иммуноглобулины класса Е, вводит свои собственные искусственные референтные интервалы, исходя из принятых значений калибраторов, определяющих диапазон величин титров IgG. Критерий «норма-патология», как правило, фиксируется на уровне половины диапазона измерений и является фиксированной величиной для всех тестов. Таким образом, протокол обработки данных теста ИФА на IgG к пАГ формально приводится в соответствие с протоколом, принятым в аллергологии для обработки результатов теста ИФА на IgЕ к пАГ. Именно этот подход использует большинство ведущих лабораторий мира: York-Nutrition, ImmuPro, Dr. Fooke, Biomerica, US Biotek, Genova Diagnostic, Meta Merix, Pinner и др. Аналогичный подход используется и в тестах ALCAT, NuTron, Сito.
С нашей точки зрения, подобный искусственный “аллергологический” подход является физически некорректным и приводит к существенным ошибкам в идентификации патологических иммунокомплексных реакций.
В разработанном нами подходе (методика Immunohealth™), идентификация патологических иммунокомплексных реакций «пАГ-sIgG» по результатам теста (ELISA IgG)n к пАГ, проводится на основе информации о структуре функции плотности распределения вероятности — ФПРВ (Probability Density Function), регистрируемых в эксперименте титров Сn(sIgG), в диапазоне шкалы измерений (Рис 3).
Рис 3. Вид ФРПВ для i-го теста (ELISA IgG)ni. Ti- критерий «норма-аномалия». Tf- условный критерий «норма-патология», принятый в лабораторной практике. Na- количество аномальных реакций, регистрируемых согласно критерию «норма-аномалия», Naf- количество аномальных реакций, регистрируемых согласно условному критерию «норма-патология».
В «методике Immunohealth™» величина персонифицированного критерия «норма — аномалия», c заданной точностью определяется программным путем на основе статистического анализа экспериментальных данных многокомпонентного теста (ELISA IgG)n к пАГ по разработанным алгоритмам программой Immunohealth™ IT. Базовым требованием нахождения корректного значения величины критерия «норма-аномалия», является наличие статистически представительного набора значений титров Сn(sIgG), т.е. необходимо и достаточно, чтобы величина объема выборки N тестируемых пАГ, приближенно удовлетворяла соотношению N ≥ 80.
Погрешность теста (ELISA IgG)n, как правило определяют величиной погрешности измерения амплитуды одного иммунного отклика (Рис 1), т.е. единичного значения концентрации специфических иммуноглобулинов — Сn(sIgG). В реальности, величина погрешности теста определяется не только и не столько погрешностью измерения одного иммунного отклика, а в основном, погрешностью определения числа идентифицируемых патологических иммунокомплексных реакций и соответствующих пАГ. А погрешность в определении числа пАГ-А всецело определяется значением величины титра, корректно разделяющего структуры А и В в ФРПВ (Рис 3). При фиксированном значении титра Tf, принятом в большинстве лабораторий мира на уровне половины значений шкалы измерения (Рис. 3), относительная погрешность в определении числа пАГ-А находится в пределах от 60% до 100%. Использование же персонифицированного критерия «норма — аномалия», определяемого по «методике Immunohealth™», гарантирует минимальную погрешность в определении количества пАГ-А и приводит к идентификации «кластеров» интолерантности ИС к пАГ, объединенных определенным антигенным «сродством». Таким образом, «методика Immunohealth™» позволяет не только диагностировать иммунокомплексные реакции у здоровых и больных людей, но и находить с минимальной погрешностью число пАГ-А, инициирующих патологические иммунокомплексные реакции.
Предлагаемый подход был проверен в течение более чем 15 лет на выборке более 30000 пациентов из разных популяций (США, ЕС, РФ) и на тест- системах для теста (ELISA IgG)n различных производителей. Врачи, использующие «методику Immunohealth™,» в своей практике, отмечают устойчивый положительный клинический эффект с контролем показателей системного воспаления (СОЭ, СРБ, ИЛ6, ИЛ1, ТНФ альфа и т.д.). Патогенетически этот эффект выражается в снижении нагрузки на эффекторные иммунные реакции, направленные на элиминацию причинных пищевых АГ, что достигается соблюдением персонифицированной элиминационной диеты, построенный с использованием предложенного критерия “норма – аномалия”.
Предложенная методика дает специалистам разных профилей инструмент, позволяющий использовать персонифицированную идентификацию и элиминацию причинных пАГ для лечения и профилактики неинфекционных хронических заболеваний. Это особо важно для пациентов с признаками системного воспаления, патогенеза многих неинфекционных заболеваний, таких как метаболический синдром, профилактика ожирения, современные интестинально–энтеропатические расстройства и аутовоспалительные синдромы. Одновременно методика позволяет определять статус ИС и степень пищевой адаптации по отношении к пищевым антигенам окружающей пищевой среды у здоровых людей.
Выводы научного исследования:
1. Корректно выполненный многокомпонентный иммуноферментный анализ (ELISA IgG)n, на специфические к пищевым антигенам иммуноглобулины класса G (IgG), предельно точно показывает концентрацию специфических антител, которая является отражением картины взаимодействия иммунной системы человека (здорового или больного) для каждого n –го пищевого антигена из представительной выборки из N тестируемых антигенов.
2. В «методике Immunohealth™» многокомпонентный иммуноферментный анализ (ELISA IgG)n на специфические к пищевым антигенам IgG, используется для создания индивидуальной адаптационной диеты на основе математически обоснованного критерия «норма – аномалия». Это область диетологии, а более конкретно — иммунодиетологии. Следовательно тест (ELISA IgG)n и «методика Immunohealth™» не имеют никакого отношения к диагностике «пищевой аллергии».
3. Результаты проведенных исследований позволяют сделать вывод о том, что новое направление ИММУНОДИЕТОЛОГИЯ™, базирующееся на корректно используемом многокомпонентном тесте (ELISA IgG)n к пАГ является перспективным направлением современной диетологии, в котором физически корректно учитываются индивидуальные реакции иммунной системы организма на представительную выборку пАГ.