тераностика в онкологии что это такое
Онкоэндокринология и тераностика
Наиболее значимые достижения в современной медицине возникают на стыке наук, например, молекулярной генетики и терапии, молекулярной визуализации и хирургии, дозиметрии и радионуклидной терапии.
Структура Института включает отдел ядерной медицины (радионуклидной диагностики и терапии), группа радионавигационной хирургии, лаборатория молекулярной онкоэндокринологии, лаборатория дозиметрического обеспечения тераностики, кабинет нейрофониатрической реабилитации, лаборатория онкоморфологии и онкобиобанка.
В Институте выполняется полный спектр радиоизотопных исследований патологии эндокринных органов: щитовидной железы, паращитовидной железы, надпочечников, поджелудочной железы. А также сцинтиграфия костей скелета, сердца, легких, почек (динамическая сцинтиграфия). Здесь внедряются инновационные методы интраоперационной навигации (гамма-зондирование, контрастная и аутофлуоростная ангиография).
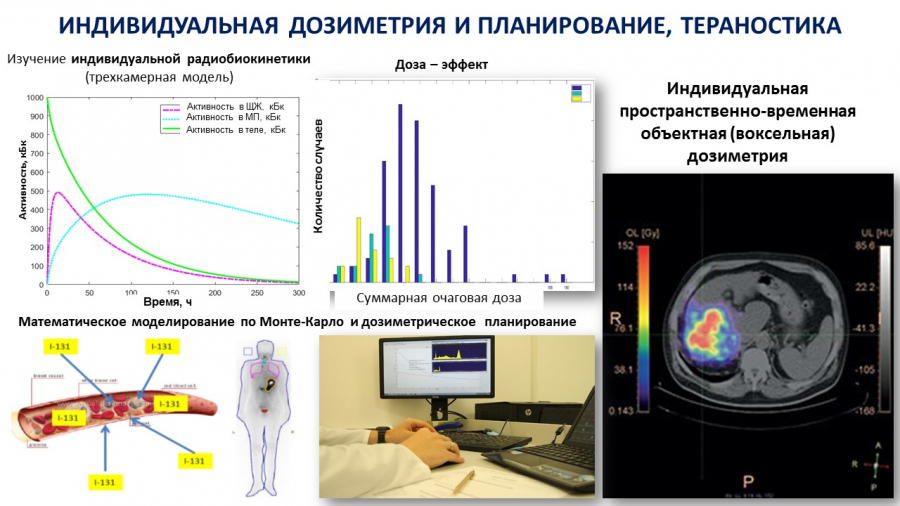
Для развития в данном направлении необходим альянс всех современных технологий молекулярной визуализации (ОФЭКТ/КТ, ПЭТКТ/МРТ), индивидуальной биодозиметрии, радиофармацевтики, онко и радио «омики»: геномики, траскрипромики, метоболомики.
Повышение эффективности терапевтического воздействия на патологический очаг и безопасности для здоровых тканей в большой степени зависит от правильного выбора молекулярной мишени и селективности воздействия на нее. Такой подход применим для диагностики и лечения различных видов заболеваний, таких как онкологические, аутоиммунные, сердечно-сосудистые, и представляется особенно актуальным в области онкологии и онкоэндокринологии.
НИИ активно занимается международным сотрудничеством с Японией и Германией, проводя совместные конференции и обмениваясь опытом.
Директором Института назначен д.м.н. Румянцев Павел Олегович, онколог-радиолог-эндокринолог, имеющий богатый опыт мультидисциплинарной научно-практической деятельности в России и за рубежом.
Тераностика – фонтан молодости ядерной медицины
Термин «тераностика» в последнее время находится на слуху и почти так же популярен, как «искусственный интеллект» и «иммунология». По данным ресурса PubMed, он впервые был употреблен в анонсе научной статьи в 2002 году. Сегодня поиск в интернете по словам «тераностика» или «терагностика» дает более 3800 результатов. Если коротко, то понятие определяется как «диагностическое тестирование, используемое для выбора таргетной терапии».
Энтузиазм медиков в связи с одобрением Lutathera дает лишь небольшое представление о предполагаемых новых возможностях от внедрения новых терапевтических пар в диагностику и лечение наиболее распространенных злокачественных опухолей, таких как рак предстательной железы, молочной железы, легких и поджелудочной железы. При раке предстательной железы объектом пристального внимания является специфический мембранный антиген предстательной железы (PSMA). PSMA гиперэкспрессирован при большинстве раковых заболеваний предстательной железы и обладает прогностической ценностью. Внедрение специфических лигандов PSMA, сопряженных с диагностическими (68Ga-, 18F-) или терапевтическими (177Lu-, 90Y-, 225Ac-) радионуклидами, привело к их огромной востребованности со стороны врачей и пациентов.
Последние разработки вызвали большой интерес участников медицинской отрасли к тераностике. Приобретение Advanced Accelerator Applications одной из крупнейших фармацевтических компаний Big Pharma (Novartis) за 3,9 млрд долларов США, недавний скачок стоимости акций Endocyte Inc. после лицензирования тераностики для лечения рака простаты, а также страховые возмещения в размере 47 500 долларов США за одну дозу Lutathera подчеркивают растущую экономическую значимость тераностики и, следовательно, ядерной медицины. Однако для реализации этих возможностей требуется создание необходимой инфраструктуры, обучение медицинских работников, включение нового терапевтического метода в уже устоявшиеся алгоритмы лечения и многое другое.
В Германии насчитывается около 40 специализированных тераностических центров, обслуживающих 80 миллионов граждан. Если пересчитать в пропорции, то в США с населением 320 миллионов человек нужно около 160 таких центров. Организации, первыми взявшие на вооружение эту технологию, такие как UCLA, UCSF и MSKCC, уже создают в США специализированные тераностические центры. Другие пока не решаются — из-за неопределенного статуса регулирования и объема возмещения затрат, что затрудняет бизнес-планирование. Кроме того, лишь немногие специалисты в США прошли необходимую подготовку по тераностике. Отсюда — неудовлетворенная потребность в подготовке широкого спектра медицинских работников, включая медсестер, технологов, физиков, сотрудников службы радиационной безопасности и врачей. В то же время, начальный этап дает возможность привлекать в ядерную медицину молодых, мотивированных людей, в том числе — специалистов из других областей: медицинской онкологии, гастроэнтерологии, эндокринологии и урологии.
Обеспечение тераностическими средствами остается еще одним важным препятствием на пути широкого распространения этого направления медицины. Эксперты, используя консервативные модели, прогнозировали ежегодную потребность около 30 000 доз Lutathera для нейроэндокринных опухолей и около 160 000 доз 177Lu-PSMA для пациентов с раком предстательной железы. Исходя из 250 рабочих дней в году, получается в среднем 760 доз в день. То есть, с некоторым запасом необходимо производить 800-1000 доз ежедневно. Однако текущая производственная инфраструктура, а также объемы поставок 177Lu абсолютно не готовы к удовлетворению этого спроса. Этот дефицит дает возможность промышленности, страховым компаниям, поставщикам медицинских услуг и специалистам сферы здравоохранения выработать взаимовыгодные решения.
Как было сказано выше, спрос на тераностику будет высоким. С развитием этого направления и появлением дополнительных новых средств он будет расти. Эти новые соединения будут применимы к NET и другим опухолям, экспрессирующим рецептор соматостатина, (177Lu-Satoreotide), лиганды рецептора нейротензина-1, возможно в том числе, и для рака поджелудочной железы (177Lu-3BP-227), CD37-связывающие антитела для гематологических злокачественных новообразований (Betalutin) и недавно одобренные 131 MIBG (Azedra) для нейробластомы и феохромоцитомы. Используемые с недавних пор лиганды, нацеленные на опухолевую строму (фибробластный активационный белок (Fibroblast Activation Protein — FAPI), могут найти еще более широкое применение при различных раковых заболеваниях.
Таким образом, тераностика предоставляет уникальные новые возможности и ставит новые задачи для ядерной медицины и регуляторов в этой отрасли, страховых компаний и систем здравоохранения. Но на раздумье времени нет – каким будет будущее, решается сегодня!
Об авторах: Кен Херманн и Вольфганг П. Фендлер работают в отделении ядерной медицины клиники Universitätsklinikum Essen, Эссен, Германия. Кен Херманн также сотрудничает с отделением трансляционной визуализации Ahmanson факультета молекулярной и медицинской фармакологии, университета UCLA, Лос-Анжелес, Калифорния.
Оригинал новости можно прочитать здесь
Тераностика в онкологии что это такое
Недавние исследования и достижения в области ядерной медицины показали ведущую роль радиотераностики в онкологии. Каким бы термином ни определялось это перспективное направление ― радиотераностика, тераностика, радиотаргетная терапия, радиолигандная терапия, пептид-рецепторная терапия, радионуклидная терапия ― это новый вектор развития …
Автор: Павел Румянцев
Почему за рубежом врачи отдают предпочтение ПЭТ/КТ с 68Ga ПСМА-11, а не 18F ПСМА-1007?
Мы решили сделать обзор научных зарубежных статей и рассказать почему в зарубежных клиниках врачи отдают предпочтение ПЭТ/КТ с 68 Ga ПСМА-11. Мы будем отталкиваться от публикаций, которые основываются на большой выборке пациентов и многоцентровых исследований. Это позволит избежать предвзятости, повысить репрезентативность и доказательность анализа…
Автор: Елена Каргапольцева
NCCN рекомендует ПЭТ/КТ с 68Ga-ПСМА-11 при раке предстательной железы. Почему именно его?
Вышло очередное обновление клинических рекомендаций NCCN (Национальная комплексная онкологическая сеть) по лечению рака предстательной железы и в преддверие ежегодного XVI Конгресса онкоурологов мы решили сделать краткий доказательный обзор по ПЭТ/КТ с 68 Ga-ПСМА-11. И разобраться почему именно ПЭТ/КТ с 68 Ga-ПСМА-11…
Автор: Елена Каргапольцева
PSMA–радиотераностика рака простаты
В декабре 2020 года FDA дало разрешение на широкое клиническое применение 68 Ga-PSMA-11 для молекулярной визуализации очагов рака предстательной железы при помощи ПЭТ/КТ, которое может быть информативно даже при низком уровне ПСА в крови. По результатам клинических исследований 1-3 фазы, последнее из которых…
Автор: Павел Румянцев
Пока все в мире идут в гору, нам остается укрепляться духом в пещерах
Российский рынок ядерной медицины, хронически отстающий от мировых практик по спектру применяемых радиофармпрепаратов (РФП), в 2021 году наконец‑то продемонстрировал стремление к рывку. Сначала постарались регуляторы: вступил в силу обновленный порядок изготовления РФП непосредственно…
Автор: Павел Румянцев
Тераностика – новый термин в биомедицине, индивидуализирующий ТЕРАпию через диагНОСТИКУ. Упрощенно говоря, это возможность повысить эффективность и безопасность лечения посредством выяснения биологических особенностей заболевания и организма на диагностическом этапе.
Сегодня говорят о тераностике применительно к нанотехнологиям и другим областям бимедицины, но наибольший резонанс тераностика получает в области ядерной медицины, где она получает устойчивое определение как радиотераностика.
Тераностика в онкологии что это такое
Развитие в области молекулярной визуализации также привело к распространению индивидуализированных радионуклидных методов лечения, определяемых концепцией «тераностики» для каждого пациента.
Что такое «тераностический» подход?
В тераностическом подходе с использованием радионуклидов (радиоизотопов) предполагается обнаружение опухоли с использованием уникальных биологических путей с последующим клеточным облучением опухоли терапевтическим радионуклидом. Такой подход обеспечивает эффективное лечение пациента в нужное время, с правильной дозировкой и целенаправленно.
Трансартериальная радиоэмболизация (ТARЕ)
(Y-90) трансартериальная радиоэмболизация (TARE) заряженными микросферами вошла в парадигму лечения первичных или метастатических злокачественных новообразований печени, которые не имеют шансов на резекцию, и использование каждого из них является важным методом лечения, получившим широкое распространение на днях. Его можно интерпретировать как внутриартериальную форму брахитерапии, форму лучевой терапии, при которой радиоактивные источники помещаются внутри или рядом с опухолью.
Кто кандидаты на TARE?
Требуется решить, подходят ли пациенты для лечения TARE в многопрофильной онкологической комиссии, состоящей из хирурга общего профиля, интервенционного радиолога, специалиста по ядерной медицине, медицинского онколога и гастроэнтеролога.
Кто считается подходящим кандидатом для лечения TARE:
Как мы выполняем ТАRЕ?
● Распределение и объем опухоли рассчитывают с помощью КТ или МРТ.
● Первая ангиография демонстрирует сосудистое строение печени. Перед заключительной процедурой некоторые артерии могут быть закупорены.
● Тестируемое лекарство используется для определения количества, улетевшего в легкие.
● Через 15 дней проводится вторая ангиография через паховую вену.
● Микросферы вводятся в сосуды опухоли и / или сосуды, которые питают опухоль.
Заполнив контактную форму ниже, вы можете задать вопросы и / или запросить дополнительную информацию у наших экспертов о ядерной медицине (ядерной онкологии) в больницах Группы Флоренс Найтингейл.
«Пока все в мире идут в гору, нам остается укрепляться духом в пещерах»
Российский рынок ядерной медицины, хронически отстающий от мировых практик по спектру применяемых радиофармпрепаратов (РФП), в 2021 году наконец‑то продемонстрировал стремление к рывку. Сначала постарались регуляторы: вступил в силу обновленный порядок изготовления РФП непосредственно в медорганизации, у игроков появилась возможность заключать тематические специнвестконтракты, регистрацию прошли (или ожидают) новые генераторы радионуклидов. Следом было сделано несколько бодрых анонсов по расширению терапевтических мощностей частных и государственных операторов. Резкого роста количества случаев радионуклидной диагностики и терапии (как по отдельности, так и вместе) эти изменения пока, конечно, не вызвали. Предвосхитить и ускорить тектонические сдвиги в ядерной отрасли вызвалась Ассоциация развития тераностики, возникшая, без преувеличения, в чистом поле. Оценить исходные позиции сегмента в интервью Vademecum попытался научный руководитель профессионального объединения, главный специалист онколог‑радиолог ММЦ «СОГАЗ‑Медицина» Павел Румянцев.
«Мы видим то, что лечим»
– На фоне разнообразия международных исследований, стартапов и уже работающих в ряде стран технологий складывается впечатление, что Россия в области тераностики все еще бесконечно далека от прорывов. Но хоть что‑то нам удалось внедрить в рутинную практику?
– В мире тераностика как часть ядерной медицины де‑факто началась в 1942 году, когда в США были опубликованы первые результаты лечения радиоактивным йодом в Massachusetts General Hospital, – это был первый удачный опыт. Долго сомневались, изучали безопасность этого метода, но оказалось, что йод захватывается преимущественно клетками щитовидной железы, а для других клеток сравнительно безопасен.
В основе тераностики лежит визуальный симбиоз диагностики и лечения, иначе говоря, мы видим то, что лечим. В Россию тераностика пришла через внедрение радиойодтерапии спустя много лет – в 1982 году. Сегодня центров радионуклидной терапии в стране более десяти, и их число продолжает расти. Однако темп роста радиотераностики у нас значительно ниже, чем в западных странах, где условия для ее развития создает государство. В той же Америке или Австралии ценятся исследователи и результаты их интеллектуальной деятельности, есть рынок ядерной медицины – то, чего у нас нет до сих пор. Отчасти стимулом развития тераностики в плане радиойодтерапии, как ни странно это звучит, стала авария на Чернобыльской АЭС, после которой резко возросла заболеваемость раком щитовидной железы среди детей. Но в то время на всю страну было лишь одно отделение радионуклидной терапии (РНТ) – в Обнинске.
Первое отделение радионуклидной терапии, соответствующее международным требованиям, удалось запустить в НМИЦ эндокринологии лишь в 2015 году. Мы изучили, как они устроены в других странах, и взяли курс на гармонизацию, смогли довольно быстро методически и технологически догнать коллег. Наше отделение вошло в мировой рейтинг лучших центров компетенций по радиотераностике рака щитовидной железы, на базе него разработано несколько патентов. Но надо двигаться дальше – это лишь стартовая ступень.
– Почему же тогда вы оставили этот центр?
– Один мой британский коллега Джеффери Флеминг как‑то произнес запомнившуюся мне фразу: «Дай бог заработать столько денег, чтобы приобрести выдающегося руководителя». Я бы добавил к ней: «…который стремится к развитию». Это ответ на ваш вопрос. Для себя я не вижу перспектив в госсекторе. Все, что ты развиваешь и создаешь, в госсекторе, как ни странно, становится предметом ограниченного обладания и консервации. Но не становится тем, что можно широко внедрить в практику, конкурировать и совершенствовать.
Я не готов работать далее в формате, когда легкодоступное финансирование используется не столько для развития, сколько для собственного укрепления, без стремления объединяться для многоцентровых исследований, честно конкурировать и развиваться. Поэтому когда я искал новое место работы, то госсектор даже не рассматривал, а выбирал наиболее амбициозный проект в частном секторе, где нет иждивенческой позиции, но есть стремление развивать перспективные направления, делать трансфер новейших технологий и внедрять современный менеджмент в биомедицине.
– Есть ощущение, что такую капиталоемкую тему, как тераностика, можно развивать только за счет государственных инвестиций.
– Мультидисциплинарность и мультимодальность – это будущее медицины, и тераностика в этом смысле отличный пример. Тераностика предполагает работу на основе данных метаболических маркеров и молекулярно‑генетических исследований, может качественно улучшить результаты лучевого, хирургического и лекарственного методов лечения в онкологии. Поэтому для этого направления очень важно умение работать в команде, но, к сожалению, в России пока это мало у кого получается.
Сначала я думал, что для этого нужен какой‑то хороший приказ, а потом – наказывать тех, кто этот приказ не исполняет. Потом пришло в голову, что, может быть, нужно на своем примере показать, как надо. Но когда и этот вариант не сработал, стало понятно, что единственный «отказоустойчивый» механизм, который обеспечит качественный и непрерывно совершенствуемый продукт в медицине, – это совпадение стратегических интересов, долгосрочно выгодное всем сторонам.
Когда финансовый результат покрывает издержки, а прибыль позволяет вкладываться в развитие, появляются все новые точки роста. В мире именно так и происходит. Государственный сектор этот механизм не может воспроизводить, а частный – потенциально способен.
– Почему эту концепцию не удалось развить, скажем, в Обнинске?
– МРНЦ долгое время был монополистом в радионуклидной терапии, очень поизносился и застоялся. По мне, это отделение надо было закрыть и сделать там музей лет эдак 20 лет назад. Отличный бы музей получился, познавательный. Длительная «естественная монополия» подспудно навредила развитию отечественной ядерной медицины – по образу и подобию обнинского центра стали формироваться новые отделения РНТ в стране. Тот случай, когда дрова пытаются использовать в качестве облицовочного материала. Такой эффект низкой базы. В НМИЦ эндокринологии удалось создать отделение нового поколения, и хотелось, прежде всего себе, доказать, что за те же деньги и в более короткие сроки можно сделать отделение мирового уровня. Продемонстрировать, что это возможно в России. Все дело в нас – если мы допускаем, что можно лечить за государственный счет в «убитом» отделении старыми методиками, не публиковать данные, жить на потоке и не реинвестировать в обновление, то о каком развитии тут вообще можно говорить? Самое сложное – убедить людей в том, что нужно работать прозрачно и доказательно, стремиться к обновлению, а не шагать под флагом уникальности, неповторимости и ничем не подкрепленного лидерства.
– Мировому научному сообществу хорошо известно, что РНТ костных метастазов, за исключением самого последнего из препаратов – Ксофиго (радия хлорид‑223), имеет сугубо паллиативное значение. Ее цель – уменьшить болевой синдром, повысить качество жизни пациентов. Но она, к сожалению, не продлевает жизнь. Об этом говорится во всех доказательных научных работах в мире. У нас же заявляют о том, что есть расчеты, подтверждающие достоверное увеличение продолжительности жизни. Но почему‑то столь важные данные не публикуются, а хранятся в тайне от мировой доказательной науки.
– Возможно, это такой маневр в расчете на получение квот? Никто же не будет направлять значительные объемы финансирования на паллиатив.
– Это конъюнктурный путь, отвлекающий ресурсы и силы от создания новых направлений. Понятно, что тренд правильный, надо идти в сторону альфа‑излучателей, разрабатывать новые лиганды, получать этот эффект, работать над уменьшением побочных осложнений, куда же без них. Здесь же путь другой – весь мир ошибался, мы доказали, и у нас все получилось, но публиковать результаты мы нигде, тем более в иностранных рецензируемых журналах, не будем. Но так мы обманываем не только мировое сообщество, но и, самое обидное, себя.
Другой пример – сейчас очевидный тренд на визуализацию и дальнейшую терапию при раке предстательной железы. И это хорошая волна, новый радиофармацевтический препарат – лютеций‑177‑ПСМА, обнадеживающие результаты клинических исследований 3‑й фазы. Что происходит у нас?
Сначала в Москве, а затем и на федеральном уровне появляется идея проводить ПЭТ/КТ‑диагностику и контроль лечения рака предстательной железы с лютецием‑177‑ПСМА с помощью РФП на основе фтора‑18‑ПСМА‑1007. Но это противоречит принципам тераностики, так как отсутствует тераностическая пара: фтор – не металл и лиганд ПСМА‑1007 не проходил КИ.
Из международных рекомендаций в сфере тераностики следует, что подобные исследования должны проводиться с галлием (галлий‑68‑ПСМА‑11), который вкупе с лютецием‑177‑ПСМА образует тераностическую пару, прошедшую 3‑ю фазу КИ. Известно, что применение фтора‑18‑ПСМА‑1007 часто может давать ложноположительные результаты.
Именно галлий‑68‑ПСМА‑11 является фундаментом для развития тераностики при раке предстательной железы. В первую очередь мы должны опираться на доказательную медицину, на результаты рандомизированных КИ, проведенных на большой выборке пациентов в передовых международных центрах. Совместное руководство Европейского общества ядерной медицины (EANM) и американского общества (SNMMI) основано на данных исследований с использованием галлия‑68‑ПСМА‑11, изучение которого проводилось 10 лет. Фтор‑18‑ПСМА‑1007 подобной доказательной базой не обладает.
Отсутствие качественного, соответствующего правилам GMP генератора галлия‑68 в РФ создает большие проблемы развитию тераностики. Но это означает, что проблему надо решать, а не заниматься самодеятельностью и подлогом, тем более когда это касается репутации научного и врачебного сообщества и качества медицинской помощи пациентам. Мы сами закладываем себе под ноги пехотные мины, отрезая путь к развитию и признанию.
«Мы не хотим отставать и проигрывать»
– В любом случае для схемы, о которой вы говорите, у нас нет в доступе ни галлия, ни лютеция. А фтор есть.
– Да. За неимением гербовой пишем на простой, почему бы нет? Но тогда это должно быть честно и доказательно. Давайте проведем собственное КИ 3‑й фазы и докажем, что так тоже можно – не менее эффективно и безопасно. В противном случае подмена понятий и антинаучный подход укореняются. И отставание нарастает. В итоге, пока все в мире идут в гору, нам остается укрепляться духом в пещерах. Это деструктивный путь. Именно поэтому я хотел бы предложить нашему мультидисциплинарному сообществу альтернативную идеологию, объединяющую стратегически мыслящих специалистов в творческие инициативные команды. Мы создали Ассоциацию развития тераностики, потому что не хотим отставать и проигрывать зарубежным конкурентам.
– А стратегически мыслящие у нас есть?
– А отчего бы им не быть? Российские специалисты, особенно молодежь, могут конкурировать на мировом рынке – они ничуть не хуже зарубежных коллег, а даже предприимчивее и сноровистее, более мобильные, коммуникабельные, готовые учить языки, если надо. И надо меньше денег, чтобы их нанять. Сегодня есть уже 13 отделений радионуклидной терапии – все они заинтересованы в перспективах и росте. Все они изучают возможности радиотераностики с применением лютеция‑177, актиния‑225 и других. Задача ассоциации – объединять специалистов, консолидировать научные разработки и клинические данные, котируемые мировым сообществом, проводить целенаправленную информационную, аналитическую и экспертную работу, способствовать внедрению тераностики в клиническую практику. Так называемые академические знания у нас, к сожалению, по синусоиде угасают, потому что остаются достоянием узкой группы людей. В отсутствие прозрачности и конкуренции нарастает путаница и непрозрачность, при которой ни о каком развитии говорить не приходится.
– Вы планируете объединить на платформе ассоциации не только онкологов, верно?
– Конечно, нет. Онколог во многом искусственное, вынужденное обособление, как и любая другая узкая специальность. Это ограничивает междисциплинарную коммуникацию, взаимодействие со смежниками, творческий и инновационный потенциал. Онкология сегодня – это огромное поле знаний и наработок в области канцерогенеза, метаболизма, радиобиологии, генетики и так далее. Онкология в современной персонализированной биомедицине перестраивается, и это происходит в окружении смежных областей медицины, так как все они курируют один и тот же объект – человеческий организм. И поэтому онкологу, как и любому широкому и узкому врачу, нужно быть очень образованным, но главное – коммуникабельным специалистом.
Для меня не существует автономии и сепаратизма в лечении онкологических заболеваний – это работа одновременно и диагноста, и хирурга, и радиолога, и радиотерапевта, и кардиолога, и врачей других специальностей. В мультидисциплинарную команду моментально вовлекается любой из них.
Именно поэтому онкологические койки во всем мире находятся в составе многопрофильных клиник. Опухоль может возникнуть в любом органе и ткани, разрушает другие системы – эндокринную, сердечно‑сосудистую, систему органов выделения, мочеполовую и так далее. Онкология в принципе своем мультидисциплинарна и многопрофильна. В экономически развитых странах нет практики создания онкологических центров как элемента национальной системы здравоохранения. Есть частные и частно‑государственные онкологические клиники, но большей частью они ориентированы на сложные случаи, требующие высочайших технологий и опыта. Если нет мультидисциплинарного консорциума внутри каждой многопрофильной клиники, онкология начинает становиться недоступной, дорогой, малоэффективной, высокотоксичной и поздней.
– Вы сказали про продвинутые отделения радионуклидной терапии. А что они могут на своей базе внедрить?
– В России действительно 90% отделений оснащены однофотонной эмиссионной томографией (ОФЭКТ), в большинстве случаев сильно устаревшей, которая зачастую годится только для музея. Я не продавец оборудования и лоббировать ничего не стану. Сегодня мы понимаем, что технология ОФЭКТ – часть диагностики, которая не может быть проведена на ПЭТ/КТ. А еще этот аппарат может использоваться для терапии – есть лечебные РФП, которые видно только в спектре ОФЭКТ. И ПЭТ, и ОФЭКТ – комплементарные технологии, и главное, чего недоставало ОФЭКТ до последнего времени, – количественного критерия, который позволяет оценить не просто наличие опухолевого процесса, но и его масштабы. Мы разработали методику, которая позволяет делать это на ОФЭКТ. Так что если пациенту поставлен диагноз, но мы не знаем стадию и с чего начать, если есть возможность сделать исследование на ОФЭКТ, это нужно сделать, чтобы не потерять кандидата на ту же самую радиотераностику. Сегодня можно с помощью ОФЭКТ делать исследование с ПСМА – для этого регистрируется холодный набор, и скоро такая возможность появится. Таких примеров в мире очень много.
– Ассоциация может участвовать в нормотворчестве. Как вы оцениваете недавно вступивший в силу приказ Минздрава №1218? Упрощает ли этот регламент изготовление и применение РФП, в том числе для тераностики?
– Я принимал непосредственное участие в разработке этого приказа. Это движение в сторону хоть какого‑то нормирования – предыдущий документ вообще был примитивным, хотя был необходим и сыграл положительную роль на том этапе. Изначально, кстати, он был ориентирован на ПЭТ, но по умолчанию накрыл и всю радионуклидную диагностику и терапию. Однако критерии качества не были прописаны, а у Минздрава и Росздравнадзора попросту не было ресурсов для их создания. В отличие от любого другого диагностического или лекарственного средства, РФП нельзя хранить, так как радиоактивный изотоп распадается. В результате собралась экспертная группа, и в итоге было принято решение принять эволюционный приказ – сначала ввести обязательные требования к организации, базовые параметры, которые, однако, ничего нам не скажут о качестве работы. Есть международная практика на этот счет – многие клиники, даже в Европе, до недавнего времени работали в формате «академических» КИ, то есть фактически, как у нас это описано в приказе №1218.
Сегодня все зарубежные клиники перешли или переходят к стандартам, предъявляемым к производству на месте. В нашем случае об этом говорить пока рано, но процесс перехода запущен. Сейчас стоит вопрос, что делать на следующем этапе, чтобы обеспечить контроль эффективности, безопасности или, скажем так, контроль качества изготавливаемой продукции на уровне международных стандартов.
В течение максимум четырех лет нужно выйти на уровень мировых практик и конкурировать по всем направлениям, в том числе с точки зрения публикаций. При нынешнем качестве организации отделений и работы даже научную статью написать, верифицировать и опубликовать очень сложно.
«Часто процедура согласования занимает от полугода и больше»
– Но ведь у нас все равно не исчезают проблемы с сырьем, например, с изотопами?
– Не совсем так. РФП можно изготавливать с помощью реактора, циклотрона или генератора. На реакторы приходится около 5% диагностических изотопов, например, йод‑123, и почти 100% – терапевтических, например, йод‑131, лютеций‑177. Фтор‑18 для ПЭТ‑диагностики получаем с помощью циклотрона, а вот галлий‑68 – с помощью генератора, прямо в условиях лаборатории. И вот здесь начинаются проблемы. В мире на подобные исследования приходится 20–30% объемов ПЭТ‑диагностики, у нас этот показатель стремится к нулю. Так случилось, потому что поставили на фтор, с помощью которого можно диагностировать далеко не все заболевания, плюс существует привязка к циклотрону. Или могут быть проблемы с тераностикой, как в случае с раком предстательной железы, при котором для диагностики необходимо использовать галлий‑68. В России, к счастью, есть собственный генератор галлия‑68, но, к несчастью, пользоваться им нельзя. Конструкция у него стандартная – напоминает бидон, но галлий‑68 он производит низкого качества, «грязный», и работать с ним на ПЭТ невозможно.
Формально у нас все в порядке, генератор‑то отечественный есть. Но в международных КИ принять участие с таким генератором галлия‑68 невозможно. Недавно с большим трудом удалось договориться с одним из организаторов международных КИ о том, чтобы он за свой счет прислал в РНЦРХТ генератор.
Однако затем выяснилось, что и это сделать не получится: процедура сертификации упаковки для любой радиоизотопной продукции при провозе через российскую таможню оказалась ужасно долгой. Сертификацию упаковки международных компаний контролирует «Росатом», бюрократические процедуры значительно удлиняют путь инновационных РФП к пациентам. Часто такая процедура согласования занимает от полугода и больше. К сожалению, интересы пациентов у нас часто не на первом месте. Наверное, к этой проблеме стоит подключаться пациентским организациям, если они хотят в ближайшее время увидеть в стране высокого качества РФП и иметь возможность лечиться по международным протоколам в России. В общем, мы сами себе создаем трудности и остаемся в пещере.
– Что в такой ситуации можно предпринять?
– Если мы не можем создать свой продукт, не можем наладить его серийное производство, нужно регистрировать и, по возможности, локализовать наиболее продвинутые импортные разработки. Генератор галлия‑68 «живет» 280 дней – максимум год, соответственно, мы могли бы и планируем здесь, в Санкт‑Петербурге, создать такое производство для заправки. Иностранным компаниям невыгодно регистрировать здесь свои генераторы, так как у нас нет должного объема рынка, и когда он появится – неизвестно. А нет его потому, что многим выгоднее грузить имеющиеся мощности и работать только на циклотронном фторе‑18. Можно сколько угодно говорить, что галлий неудобен и менее предпочтителен, но для всех сторонников этой позиции у меня есть одна очень плохая новость: во всем мире это не так. Более того, все исследовательские радиолиганды «едут» на галлии‑68, то есть качественную диагностику и дальнейшее лечение того же рака предстательной железы, например, с помощью лютеция‑177, можно делать только в тераностической паре с галлием‑68. Без галлия‑68 невозможно ни участвовать, ни проводить КИ, ни создавать свои собственные РФП.
– Возможно, эту тему способен развить «Росатом», который как раз планирует выпускать лютеций‑177?
– Трудно комментировать эту инициативу, так как «Росатом» владеет всеми высокопоточными, то есть пригодными для ядерной медицины, ядерными реакторами – увы, в статусе «собаки на сене». Корпорация очень хорошо развита институционально, но не направляет усилия на развитие ядерной медицины. Россия является самым крупным в мире поставщиком сырья для производства сверхчистого, «медицинского», лютеция‑177. Причем сырье для получения лютеция‑177 добывается преимущественно в нашей стране в таких масштабах, что можно удовлетворить всю мировую потребность на 5–10 лет вперед. В результате наш же лютеций‑177, но уже медицинского качества, мы вынуждены закупать в Европе с огромной добавочной стоимостью. И это огромная проблема для развития ядерной медицины в нашей стране, в частности радиотераностики. У нас есть все условия вырваться в этой области в мировые лидеры. Удивительно, но положиться на свои собственные возможности и силы, хотя бы в плане производства лютеция‑177 медицинского качества, мы сегодня не можем. Надеюсь, что когда‑нибудь в «Росатоме» возобладает здравый смысл и экономическое мышление.