теплоемкость воды что это такое
Удельная теплоемкость воды

Всего получено оценок: 165.
Всего получено оценок: 165.
Удельная теплоемкость — это физическая величина, которая используется для расчета количества теплоты, необходимого для нагревания вещества до определенной температуры. При понижении температуры значение этой величины применяется для оценки количества теплоты, которое выделится в процессе охлаждения, а удельные теплоемкости различных веществ могут иметь значения, отличающиеся в десятки раз. Повседневная жизнь человека в значительной степени зависит от качества воды и ее параметров, в ряду которых удельная теплоемкость воды занимает важное место.
Общее определение удельной теплоемкости
Напомним, что передача энергии от одного тела к другому без совершения работы называется теплопередачей или теплообменом. Теплообмен происходит, когда тела имеют разные температуры. Величина энергии, переданная телу в результате теплообмена, называется количеством теплоты Q. В соответствии с первым законом термодинамики количество теплоты Q равно изменению внутренней энергии тела ΔU:
Следует помнить, что количество теплоты определяет только изменение внутренней энергии, а не его конкретное значение. Полная величина внутренней энергии — это сумма потенциальной энергии взаимодействия частиц, из которых состоит физическое тело, и кинетической энергии их беспорядочного движения.
Изменение внутренней энергии пропорционально массе тела m и изменению температуры:
Коэффициент пропорциональности c в формуле (2) называется удельной теплоемкостью вещества:
В Международной системе СИ количество теплоты измеряется в джоулях, масса — в килограммах, а разница температур — в градусах Кельвина. Значит единица измерения удельной теплоемкости будет:
Из формул (3), (4) следует, что величина удельной теплоемкости показывает, какое количество теплоты необходимо, чтобы нагреть 1 кг вещества на 1 0 K.
Раньше, до принятия в системе СИ в качестве единицы измерения энергии джоуля, использовалась специальная единица — калория (кал), равная количеству теплоты, которое нагревает 1 грамм воды на 1 градус Цельсия. Опытным путем определен, так называемый, механический эквивалент теплоты — соотношение между джоулем и калорией:
В настоящее время данную единицу используют при определении количества потребленной тепловой энергии в жилых домах и на предприятиях.
Значения удельных теплоемкостей для твердых, жидких и газообразных веществ определены с помощью физических измерений и сведены в справочные таблицы.
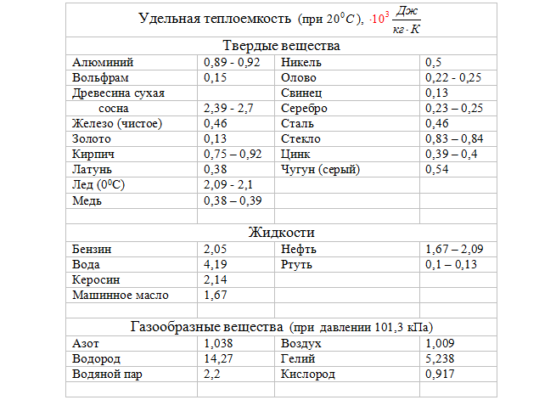
Особенности удельной теплоемкости воды
Из приведенной таблицы видно, что у металлов значения теплоемкостей довольно низкие (например у свинца это 140 Дж/кг* 0 K), поэтому для нагрева металлических предметов требуются немного тепла. Удельная теплоемкость воды равна 4200 Дж/кг* 0 K, что на много больше аналогичных металлических параметров. Исследования показали, что это одно из самых высоких значений среди жидких материалов.
В твердом агрегатном состоянии вода (лед) имеет в два раза меньшее значение удельной теплоемкости — 2100 Дж/кг* 0 K, а в газообразном состоянии (водяной пар) — 2200 Дж/кг* 0 K.
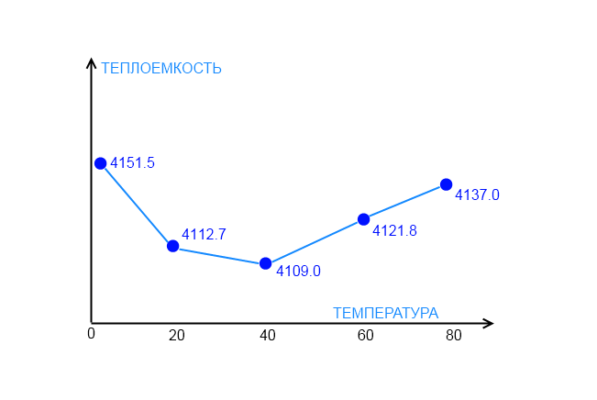
Табличные значения для удельных теплоемкостей приводятся, как правило, для фиксированных температур в диапазоне 20-25 0 С (нормальная или комнатная температура). Это связано с тем, что величина удельной теплоемкости зависит от температуры, что характерно не только для воды, но и для других веществ. На приведенном ниже графике показана экспериментально полученная зависимость удельной теплоемкости воды при различных температурах. Видно, что 0 0 С до 37 0 С теплоемкость воды снижается, а затем снова растет. Точное определение удельной теплоемкости воды производится с помощью приборов, называемых калориметрами.
Обладание водой максимальной величиной удельной теплоемкости приводит к следующим полезным применениям в различных сферах человеческой деятельности:
Что мы узнали?
Итак, мы узнали, что величина удельной теплоемкости показывает, какое количество теплоты необходимо, чтобы нагреть 1 кг вещества на 1 0 K. Значение удельной теплоемкости воды равно 4200 Дж/кг* 0 K при нормальных температурах. Имеется температурная зависимость теплоемкости воды от температуры. Точные значения этой величины получены экспериментально и приведены в справочниках в виде таблиц и графиков.
Удельная теплоёмкость воды, или почему мы такие, какие есть
Теплоёмкость воды (ТВ) — одно из важнейших для нашей планеты свойств воды.
Удельная теплоёмкость воды
Дадим этому термину краткое определение.
Теплоемкость вещества — это его способность аккумулировать в себе тепло. Измеряется эта величина количеством поглощаемого им тепла, при нагреве на 1°С. Например, теплоемкость воды — 1 кал/г, или 4,2 Дж/г, а почвы — при 14,5-15,5°С (в зависимости от типа почвы) колеблется от 0,5 до 0,6 кал (2,1-2,5 Дж) на единицу объема и от 0,2 до 0,5 кал (или 0,8-2,1 Дж) на единицу массы (граммы).
Теплоемкость воды оказывает существенное влияние на многие аспекты нашей жизни, но в этом материале мы сделаем акцент на ее роль в формировании температурного режима нашей планеты, а именно …
Теплоёмкость воды и климат Земли
По своему абсолютному значению теплоемкость воды достаточно велика. Из приведенного выше определения мы видим, что она существенно превышает теплоемкость почвы нашей планеты. Из-за такой разности теплоемкостей почва, по сравнению с водами мирового океана, значительно быстрее нагревается и соответственно быстрее остывает. Благодаря более инертному мировому океану колебания суточных и сезонных температур Земли не так велики, как были бы в случае отсутствия океанов и морей. Т. е. в холодное время года вода греет Землю, а в теплое охлаждает. Естественно это влияние наиболее ощутимо в прибрежных районах, но в глобальном усредненном измерении влияет на всю планету.
Естественно, что на колебания суточных и сезонных температур влияет множество факторов, но вода является одним из важнейших.
Увеличение амплитуды колебаний суточных и сезонных температур радикально изменило бы окружающий нас мир.
Например, хорошо всем известный факт — камень при резких температурных колебаниях теряет свою прочность и становится хрупким. Очевидно, что «несколько» другими были бы и физические параметры тела человека.
Аномальные свойства теплоемкости воды
Теплоемкость воды обладает аномальными свойствами. Оказывается, при повышении температуры воды ее теплоемкость уменьшается, эта динамика сохраняется до 37°C, при дальнейшем увеличении температуры теплоемкость начинает возрастать.
Заключение
В этом факте заключено одно интересное утверждение. Условно говоря, сама природа в лице Воды определила 37°C как наиболее комфортную температуру для организма человека, при условии, конечно соблюдения всех остальных факторов. При любой динамике изменения температуры окружающей среды температура воды тяготеет к 37°C.
Вот такая краткая история Теплоемкости воды 🙂
Удельная теплоемкость воды H2O
Приведены таблицы значений удельной теплоемкости воды H2O и водяного пара в зависимости от температуры и давления. В первой таблице дана удельная теплоемкость воды в жидком состоянии при нормальном атмосферном давлении и температуре от 0,1 до 100°С.
Во второй таблице значения теплоемкости указаны в интервале температуры от 0 до 800°С и давлении от 0,1 до 100 бар. Вода в этих условиях может находится в жидком или газообразном состоянии, поскольку с понижением давления и (или) с ростом температуры она переходит в пар.
Жидкая вода обладает значительной величиной массовой удельной теплоемкости, по сравнению с другими жидкостями. При атмосферном давлении и температуре до 100°С она находится в виде жидкости и ее теплоемкость изменяется в диапазоне от 4174 до 4220 Дж/(кг·град).
При температуре 20 градусов Цельсия и нормальном атмосферном давлении удельная теплоемкость воды равна 4183 Дж/(кг·град). При температуре 100°С эта величина достигает значения 4220 Дж/(кг·град).
Изменение давления и температуры воды существенно влияет на ее удельную теплоемкость. Зависимость теплоемкости воды от температуры при атмосферном давлении не линейна. При нагревании воды до 30°С теплоемкость уменьшается, затем в интервале температуры 30…40°С значение этой величины остается практически постоянным (следует отметить, что в этом диапазоне температуры вода обладает наименьшей теплоемкостью). При температуре выше 40°С ее удельная теплоемкость увеличивается и достигает своего максимума при температуре кипения.
| t, °С | 0,1 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | 50 |
|---|---|---|---|---|---|---|---|---|---|---|
| Cp, Дж/(кг·град) | 4217 | 4191 | 4187 | 4183 | 4179 | 4174 | 4174 | 4174 | 4177 | 4181 |
| t, °С | 55 | 60 | 65 | 70 | 75 | 80 | 85 | 90 | 95 | 100 |
| Cp, Дж/(кг·град) | 4182 | 4182 | 4185 | 4187 | 4191 | 4195 | 4202 | 4208 | 4214 | 4220 |
Если продолжить нагрев воды до перехода ее в пар, то тогда, при дальнейшем нагреве пара при атмосферном давлении, величина теплоемкости будет снижаться до некоторого предела, а затем снова начнет увеличиваться. Эта точка перегиба кривой теплоемкости определяется значениями соответствующих температуры и давления.
Как видно по данным в таблице, с повышением давления удельная теплоемкость воды уменьшается, но увеличивается также и температура кипения воды, например, при давлении в 100 бар (атмосфер) она находится в жидком состоянии даже при температуре 300°С. Удельная теплоемкость воды при этом составляет величину 5700 Дж/(кг·град). При продолжении нагрева воды, например до 320°С, она переходит в пар, который имеет большую теплоемкость.
Однако, при низких давлениях, вода начинает кипеть и переходит в пар при температурах гораздо ниже 100°С. Например, по данным таблицы, при давлении 0,1 бар и температуре 50°С, вода уже находится в виде водяного пара и его теплоемкость при этих условиях составляет величину, равную 1929 Дж/(кг·град).
| ↓ t, °С | P, бар → | 0,1 | 1 | 10 | 20 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|---|
| 0 | 4218 | 4217 | 4212 | 4207 | 4196 | 4186 | 4176 | 4165 |
| 50 | 1929 | 4181 | 4179 | 4176 | 4172 | 4167 | 4163 | 4158 |
| 100 | 1910 | 2038 | 4214 | 4211 | 4207 | 4202 | 4198 | 4194 |
| 120 | 1913 | 2007 | 4243 | 4240 | 4235 | 4230 | 4226 | 4221 |
| 140 | 1918 | 1984 | 4283 | 4280 | 4275 | 4269 | 4263 | 4258 |
| 160 | 1926 | 1977 | 4337 | 4334 | 4327 | 4320 | 4313 | 4307 |
| 180 | 1933 | 1974 | 2613 | 4403 | 4395 | 4386 | 4378 | 4370 |
| 200 | 1944 | 1975 | 2433 | 4494 | 4483 | 4472 | 4461 | 4450 |
| 220 | 1954 | 1979 | 2316 | 2939 | 4601 | 4586 | 4571 | 4557 |
| 240 | 1964 | 1985 | 2242 | 2674 | 4763 | 4741 | 4720 | 4700 |
| 260 | 1976 | 1993 | 2194 | 2505 | 3582 | 4964 | 4932 | 4902 |
| 280 | 1987 | 2001 | 2163 | 2395 | 3116 | 4514 | 5250 | 5200 |
| 300 | 1999 | 2010 | 2141 | 2321 | 2834 | 3679 | 5310 | 5700 |
| 320 | 2011 | 2021 | 2126 | 2268 | 2649 | 3217 | 4118 | 5790 |
| 340 | 2024 | 2032 | 2122 | 2239 | 2536 | 2943 | 3526 | 4412 |
| 350 | 2030 | 2038 | 2125 | 2235 | 2504 | 2861 | 3350 | 4043 |
| 360 | 2037 | 2044 | 2127 | 2231 | 2478 | 2793 | 3216 | 3769 |
| 365 | 2040 | 2048 | 2128 | 2227 | 2462 | 2759 | 3134 | 3655 |
| 370 | 2043 | 2050 | 2128 | 2222 | 2446 | 2725 | 3072 | 3546 |
| 375 | 2046 | 2053 | 2127 | 2218 | 2428 | 2690 | 3018 | 3446 |
| 380 | 2049 | 2056 | 2127 | 2212 | 2412 | 2657 | 2964 | 3356 |
| 385 | 2052 | 2059 | 2126 | 2207 | 2396 | 2627 | 2913 | 3274 |
| 390 | 2056 | 2061 | 2125 | 2202 | 2381 | 2600 | 2867 | 3201 |
| 395 | 2059 | 2065 | 2125 | 2200 | 2369 | 2575 | 2826 | 3137 |
| 400 | 2062 | 2068 | 2126 | 2197 | 2358 | 2553 | 2789 | 3078 |
| 405 | 2066 | 2071 | 2127 | 2195 | 2349 | 2534 | 2756 | 3025 |
| 410 | 2069 | 2074 | 2128 | 2193 | 2340 | 2517 | 2727 | 2979 |
| 415 | 2072 | 2077 | 2129 | 2192 | 2334 | 2501 | 2700 | 2936 |
| 420 | 2076 | 2080 | 2131 | 2192 | 2327 | 2487 | 2675 | 2898 |
| 425 | 2079 | 2083 | 2132 | 2190 | 2321 | 2474 | 2653 | 2863 |
| 430 | 2082 | 2086 | 2134 | 2190 | 2316 | 2462 | 2632 | 2830 |
| 440 | 2089 | 2093 | 2138 | 2190 | 2307 | 2441 | 2596 | 2773 |
| 450 | 2095 | 2099 | 2141 | 2191 | 2300 | 2424 | 2565 | 2726 |
| 460 | 2102 | 2106 | 2146 | 2192 | 2294 | 2409 | 2538 | 2684 |
| 480 | 2116 | 2119 | 2154 | 2196 | 2286 | 2385 | 2496 | 2618 |
| 500 | 2129 | 2132 | 2164 | 2201 | 2281 | 2368 | 2464 | 2569 |
| 520 | 2142 | 2146 | 2175 | 2208 | 2280 | 2357 | 2441 | 2531 |
| 540 | 2156 | 2159 | 2185 | 2216 | 2280 | 2349 | 2423 | 2502 |
| 560 | 2170 | 2173 | 2197 | 2226 | 2285 | 2349 | 2416 | 2487 |
| 580 | 2184 | 2187 | 2208 | 2233 | 2285 | 2342 | 2401 | 2465 |
| 600 | 2198 | 2200 | 2219 | 2240 | 2287 | 2336 | 2389 | 2445 |
| 620 | 2212 | 2213 | 2230 | 2250 | 2291 | 2334 | 2381 | 2431 |
| 640 | 2226 | 2227 | 2243 | 2260 | 2298 | 2337 | 2379 | 2423 |
| 660 | 2240 | 2241 | 2256 | 2272 | 2307 | 2343 | 2381 | 2421 |
| 680 | 2254 | 2255 | 2270 | 2286 | 2317 | 2352 | 2388 | 2424 |
| 700 | 2268 | 2270 | 2283 | 2299 | 2330 | 2362 | 2398 | 2429 |
| 800 | 2339 | 2341 | 2352 | 2364 | 2389 | 2414 | 2440 | 2465 |
Примечание: В таблице синим цветом показаны значения удельной массовой теплоемкости воды в жидком состоянии, а черным – значения теплоемкости водяного пара.
Формула для расчёта удельной теплоёмкости вещества
Удельная теплоёмкость — это энергия, которая требуется для увеличения температуры 1 грамма чистого вещества на 1°. Параметр зависит от его химического состава и агрегатного состояния: газообразное, жидкое или твёрдое тело. После его открытия начался новый виток развития термодинамики, науки о переходных процессах энергии, которые касаются теплоты и функционирования системы.
Как правило, удельная теплоёмкость и основы термодинамики используются при изготовлении радиаторов и систем, предназначенных для охлаждения автомобилей, а также в химии, ядерной инженерии и аэродинамике. Если вы хотите узнать, как рассчитывается удельная теплоёмкость, то ознакомьтесь с предложенной статьёй.
Формула
Перед тем, как приступить к непосредственному расчёту параметра следует ознакомиться с формулой и её компонентами.
Формула для расчёта удельной теплоёмкости имеет следующий вид:
Знание величин и их символических обозначений, использующихся при расчёте, крайне важно. Однако необходимо не только знать их визуальный вид, но и чётко представлять значение каждого из них. Расчёт удельной теплоёмкости вещества представлен следующими компонентами:
ΔT – символ, означающий постепенное изменение температуры вещества. Символ «Δ» произносится как дельта.
ΔT можно рассчитать по формуле:
m – масса вещества используемого при нагреве (гр).
Q – количество теплоты (Дж/J)
На основании Цр можно вывести и другие уравнения:
Инструкция по расчёту параметра
Рассчитать с вещества достаточно просто и чтобы это сделать нужно, выполнить следующие шаги:
В качестве примера произведём расчёт неизвестного вещества массой 480 грамм обладающего температурой 15ºC, которая в результате нагрева (подвода 35 тыс. Дж) увеличилась до 250º.
Согласно инструкции приведённой выше производим следующие действия:
Выписываем исходные данные:
Берём формулу, подставляем значения и решаем:
с=Q/(m*∆T)=35тыс.Дж/(480 г*235º)=35тыс.Дж/(112800 г*º)=0,31 Дж/г*º.
Расчёт
Выполним расчёт CP воды и олова при следующих условиях:
Для начала определяем ΔT для воды и олова соответственно:
Затем находим удельную теплоёмкость:
Таким образом, удельная теплоемкость воды составила 1 Дж/г *ºC, а олова 0,35 Дж/г*ºC. Отсюда можно сделать вывод о том, что при равном значении подводимого тепла в 28 тыс. Дж олово нагрется быстрее воды, поскольку его теплоёмкость меньше.
Теплоёмкостью обладают не только газы, жидкости и твёрдые тела, но и продукты питания.
Как рассчитать теплоемкость продуктов питания
При расчёте емкости питания уравнение примет следующий вид:
Определим теплоемкость плавленого сливочного сыра Viola. Для этого выписываем нужные значения из состава продукта (масса 140 грамм):
Затем находим с:
Полезные советы
Всегда помните, что:
Видео
Разобраться в этой теме вам поможет видео урок.
Теплоемкость воды что это такое
Большая теплоемкость воды. Удельной теплоемкостью воды называют количество теплоты, которое необходимо, чтобы поднять температуру 1 кг воды на ГС. Вода обладает большой теплоемкостью. Это значит, что существенное увеличение тепловой энергии вызывает лишь сравнительно небольшое повышение ее температуры. Объясняется такое явление тем, что значительная часть энергии расходуется на разрыв водородных связей, ограничивающих подвижность молекул воды, т. е. на преодоление упомянутой выше «склеенности» ее молекул.
Большая теплоемкость воды сводит к минимуму происходящие в ней температурные изменения. Благодаря этому биохимические процессы протекают в меньшем интервале температур, с более постоянной скоростью, и опасность нарушения этих процессов от резких отклонений температуры грозит им не столь сильно. Вода служит для многих клеток и организмов средой обитания, обеспечивающей им довольно значительное постоянство условий.
Большая теплота испарения воды. Скрытая теплота испарения есть мера количества тепловой энергии, которую необходимо сообщить жидкости для ее перехода в пар, т. е. для преодоления сил молекулярного сцепления в жидкости. Испарение воды требует довольно значительных количеств энергии. Это объясняется существованием водородных связей между ее молекулами. Именно в силу этого температура кипения воды — вещества со столь малыми молекулами — необычно высока.
Энергия, необходимая молекулам воды для испарения, черпается из окружения. Таким образом, испарение сопровождается охлаждением. Это явление используется у животных при потоотделении, а также при тепловой одышке у млекопитающих или у некоторых рептилий (например крокодилов), которые на солнцепеке сидят с открытым ртом; возможно, оно играет заметную роль и в охлаждении транспирирующих листьев. Большая теплота испарения означает, что отдача организмом даже больших количеств тепла сопровождается минимальными потерями воды, т. е. не обязательно ведет к его обезвоживанию.
Некоторые важные биологические функции воды
Большая теплота плавления воды. Скрытая теплота плавления — это мера тепловой энергии, необходимой для расплавления твердого вещества (в нашем случае — льда). Для плавления (таяния) льда необходимо сравнительно большое количество энергии. Справедливо и обратное: при замерзании вода должна отдать большое количество тепловой энергии. Это уменьшает вероятность замерзания содержимого клеток и окружающей их жидкости. Кристаллы льда особенно губительны для живого, когда они образуются внутри клеток.
Плотность и и поведение воды вблизи точки замерзания. Плотность воды от +4 до О °С понижается, поэтому лед легче воды и в воде не тонет. Вода — единственное вещество, обладающее в жидком состоянии большей плотностью, чем в твердом.
Поскольку лед плавает в воде, он образуется сначала на ее поверхности и лишь затем в придонных слоях. Если бы замерзание прудов шло в обратном порядке, снизу вверх, то в областях с умеренным или холодным климатом жизнь в пресноводных водоемах вообще не могла бы существовать. Лед покрывает толщу воды, как одеялом, что повышает шансы на выживание у организмов, обитающих в воде. Это важно в условиях холодного климата и в холодное время года, но, несомненно, особенно важную роль это играло в ледниковый период. Кроме того, находясь на поверхности, лед быстрее и тает. То обстоятельство, что слои воды, температура которых упала ниже 4°С, поднимаются вверх, обусловливает перемешивание воды в больших водоемах. Вместе с водой циркулируют и находящиеся в ней питательные вещества, благодаря чему водоемы заселяются живыми организмами на большую глубину.
Большое поверхностное натяжение и когезия воды. Когезия — это сцепление молекул физического тела друг с другом под действием сил притяжения. На поверхности жидкости существует поверхностное натяжение — результат действующих между молекулами сил когезии, направленных внутрь. Благодаря поверхностному натяжению жидкость стремится принять такую форму, чтобы площадь ее поверхности была минимальной (в идеале — форму шара). Из всех жидкостей самое большое поверхностное натяжение у воды. Значительная когезия, характерная для молекул воды, играет важную роль в живых клетках, а также при движении воды по сосудам ксилемы в растениях (гл. 13). Многие мелкие организмы извлекают для себя пользу из поверхностного натяжения: оно позволяет им удерживаться на воде или скользить по ее поверхности.
Вода как реагент. Биологическое значение воды определяется тем, что она представляет собой один из необходимых метаболитов, т. е. участвует в метаболических реакциях. Вода используется, например, в качестве источника водорода при фотосинтезе, а также участвует в реакциях гидролиза.
Некоторые важные с биологической точки зрения функции воды перечислены в таблице.





