Протеолиз что это такое
ПРОТЕОЛИТИ́ЧЕСКИЕ ФЕРМЕ́НТЫ
Том 27. Москва, 2015, стр. 625
Скопировать библиографическую ссылку:
ПРОТЕОЛИТИ́ЧЕСКИЕ ФЕРМЕ́НТЫ (протеазы), группа ферментов класса гидролаз, катализируют внутри- и внеклеточное расщепление (протеолиз) пептидных связей C(O) ─ NH в белках и пептидах живых организмов. Выделяют две подгруппы П. ф.: экзопептидазы (пептидазы), отщепляют аминокислоты с аминного ( аминопептидазы ) или карбоксильного ( карбоксипептидазы ) конца молекулы белка или пептида; эндопептидазы (протеиназы; этот термин иногда используется также как синоним термина «П. ф.»), гидролизуют преим. внутр. пептидные связи. Большинство изученных П. ф. синтезируются в виде неактивных предшественников – проферментов, или зимогенов. Их активация происходит путём ограниченного протеолиза – избирательного гидролиза определённых пептидных связей, протекающего либо автокаталитически, либо под действием др. протеиназ, и обычно сопровождается отщеплением пептидов. П. ф. разнообразны по физико-химич. свойствам. В зависимости от локализации П. ф. протеолиз происходит при разл. значениях pH. Напр., пепсин и гастриксины желудка – при pH 1,5–2, ферменты лизосом – при pH 4–5, П. ф. сыворотки крови, тонкого кишечника – при нейтральных или слабощелочных значениях. Некоторые П. ф. в качестве кофактора используют ионы металлов (в т. ч. коллагеназа, термолизин). П. ф. имеют разную субстратную специфичность, которая определяется в осн. особенностями боковых групп аминокислот. Так, напр., трипсин гидролизует связи, образованные карбоксильной группой осно́вных аминокислот – лизина и аргинина, а эластаза – аминокислот с небольшими боковыми цепями – аланина и серина. На расщепление пептидных связей влияет также их доступность при наличии пространственной структуры гидролизуемого субстрата. Ферменты с узкой субстратной специфичностью (напр., коллагеназа, калликреин) гидролизуют пептидные связи, образованные строго определёнными аминокислотными остатками, ферменты с широкой субстратной специфичностью (в т. ч. пепсин, папаин) – связи, образованные многими аминокислотами. В плазме крови и др. биологич. жидкостях, а также в разных клетках и тканях присутствуют белковые ингибиторы П. ф., которые могут блокировать активность отд. ферментов или групп ферментов. Благодаря им осуществляется регуляция активности П. ф. в физиологич. условиях, что предохраняет белки от неконтролируемого расщепления.
Протеолиз
Полезное
Смотреть что такое «Протеолиз» в других словарях:
ПРОТЕОЛИЗ — ПРОТЕОЛИЗ, процесс расщепления белков и пептидов в организме с участием специальных ферментов. Играет важную роль при усвоении белков пищи, в процессе свертывания крови, мобилизации запасных белков семян при прорастании и др … Современная энциклопедия
ПРОТЕОЛИЗ — процесс расщепления белков и пептидов в организме, катализируемый специальными протеолитическими ферментами. Играет важную роль при усвоении белков пищи, в процессе свертывания крови, мобилизации запасных белков семян при прорастании и др … Большой Энциклопедический словарь
протеолиз — сущ., кол во синонимов: 1 • расщепление (20) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Протеолиз — ПРОТЕОЛИЗ, процесс расщепления белков и пептидов в организме с участием специальных ферментов. Играет важную роль при усвоении белков пищи, в процессе свертывания крови, мобилизации запасных белков семян при прорастании и др. … Иллюстрированный энциклопедический словарь
Протеолиз — Схема действия эндопептидаз и экзопептидаз Протеолиз процесс ферментативного гидролиза белков, катализирующийся протеолитическими ферментами (протеазами). Протеолиз играет большую роль в следующих процессах в организме: расщепление до аминокислот … Википедия
протеолиз — процесс расщепления белков и пептидов в организме, катализируемый специальными протеолитическими ферментами. Играет важную роль при усвоении белков пищи, в процессе свёртывания крови, мобилизации запасных белков семян при прорастании и др. * * *… … Энциклопедический словарь
протеолиз — proteolizė statusas T sritis chemija apibrėžtis Hidrolizinis baltymų skaidymas iki aminorūgščių. atitikmenys: angl. proteolysis rus. протеолиз … Chemijos terminų aiškinamasis žodynas
протеолиз — (протеины + греч. lysis растворение, разрушение) процесс ферментативного расщепления белков до пептидов и аминокислот … Большой медицинский словарь
Протеолиз — процесс гидролиза пептидных связей (См. Пептидная связь), катализируемый протеолитическими ферментами (См. Протеолитические ферменты). Наряду с расщеплением до аминокислот белков пищи (а также собственных белков организма в процессе… … Большая советская энциклопедия
протеолиз — проте олиз, а … Русский орфографический словарь
Голодные химеры: направленный протеолиз в качестве лекарства
Молекула PROTAC одновременно связывает мишень и убиквитинлигазу, которая помечает ее для деградации в протеасоме. Рисунок в полном размере.
Автор
Редакторы
Большинство таргетных препаратов направлено на предотвращение работы белка-мишени путем ингибирования. Новый класс препаратов работает совершенно по другому принципу: он использует клеточную систему деградации белка для того, чтобы уничтожить мишень. PROTAC — протеолиз-таргетированная химера — как мостик связывает белок-мишень с убиквитинлигазой, которая метит его для деградации. Этот класс препаратов открывает новые принципы работы лекарств и мишени, доселе неизвестные. В этой статье спецпроекта о современных лекарствах рассказывается история создания PROTAC’ов и их современное состояние.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.
Партнер спецпроекта — компания Cytiva — образовалась в результате продажи подразделения GE Healthcare Biopharma корпорации Danaher Corporation. Cytiva — глобальный поставщик технологий и услуг, которые продвигают и ускоряют разработку и производство терапевтических средств. У компании богатое наследие, насчитывающее сотни лет. Клиенты Cytiva проводят мероприятия по спасению жизни, начиная от фундаментальных биологических исследований и заканчивая разработкой инновационных вакцин, биологических препаратов и новейших клеточных и генных терапий. Задача компании — предоставить инструменты и услуги, которые им необходимы, чтобы они работали лучше, быстрее и безопаснее, что приведет к лучшим результатам для пациентов.
В 1970-х годах в изучении онкологических заболеваний произошел переворот. В 1970 году Питер Фогт и Питер Дюсберг обнаружили трансформирующий фактор вируса саркомы Рауса [1], позже названный v-src. В 1976 году Гарольд Вармус и Майкл Бишоп обнаружили, что в клетках человека есть аналог вирусного src, клеточный ген с-src, который, как оказалось позже, кодирует тирозинкиназу. В последующие годы были идентифицированы и другие онкогены и опухолевые супрессоры: гены, которые контролируют опухолевую трансформацию и прогрессию.
Теперь у исследователей-онкологов появились мишени для направленной терапии и надежда, что можно отойти от токсичных препаратов, которые были единственным доступным средством химиотерапии (в рамка нашего спецпроекта выходила статья о поиске мишеней [2]). В 1980-х годах были предприняты первые попытки ингибировать продукты онкогенов с помощью мышиных антител [3], но такие препараты оказались малоэффективными и вызывали иммунную реакцию. В начале 1990-х случился прорыв [4]: практически одновременно были созданы и одобрены первый киназный ингибитор — иматиниб («Гливек») [5] — и первое антитело — трастузумаб («Герцептин»).
За этим последовал бум ингибиторов киназ и терапевтических антител, в результате которого создали препараты против множества релевантных киназ и поверхностных белков. Однако многие из идентифицированных онкогенов не являются киназами, или даже не обладают ферментативной активностью. Поэтому у них просто нет активного центра, который можно заблокировать низкомолекулярным веществом. Для того чтобы на них воздействовать, приходится использовать сравнительно большие молекулы — ингибиторы белок-белковых взаимодействий (PPI inhibitors), — часто требующие многих сложных методов для подтверждения правильного связывания с мишенью (рентгеноструктурного анализа комплекса, ЯМР и других [6]). Иногда такие мишени оказывались undruggable, то есть не поддающимися воздействию лекарствами.
Жизнь белков внутри клетки сложна и сурова. Как быть, если тебе вручили «черную метку»? На «Биомолекуле» уже немало было сказано про природу этой метки (белка убиквитина): «Вездесущий убиквитин» [8], «“Вездесущий убиквитин” возвращается» [9]; а недавно вышел обзор про протеостаз, передающий весь масштаб жизни и смерти белков: «Война и мир: как устроить белковую жизнь?» [10].
Протеасома
Протеасомную систему деградации открыли в 1970-х годах в лабораториях Аврама Гершко в Хайфе и Ирвина Роуза в Филадельфии. До этих исследований считалось, что белки могут деградировать только неспецифично в лизосомах, без затрат АТФ, несмотря на ряд работ (например Симпсона в 1953-м [11]), показывающих энергозависимую деградацию белков внутри клетки. Гершко и его аспирант Аарон Чехановер обнаружили, что деградация белков осуществляется двумя белковыми комплексами, один из которых деградирует белки (протеасома), а второй помечает их специальными метками, позже идентифицированными как полимеры белка убиквитина [8], направляя их на деградацию. В результате работ этой группы, лаборатории Александра Варшавского и ряда других в 1980-х была полностью идентифицирована система протеасомной деградации.
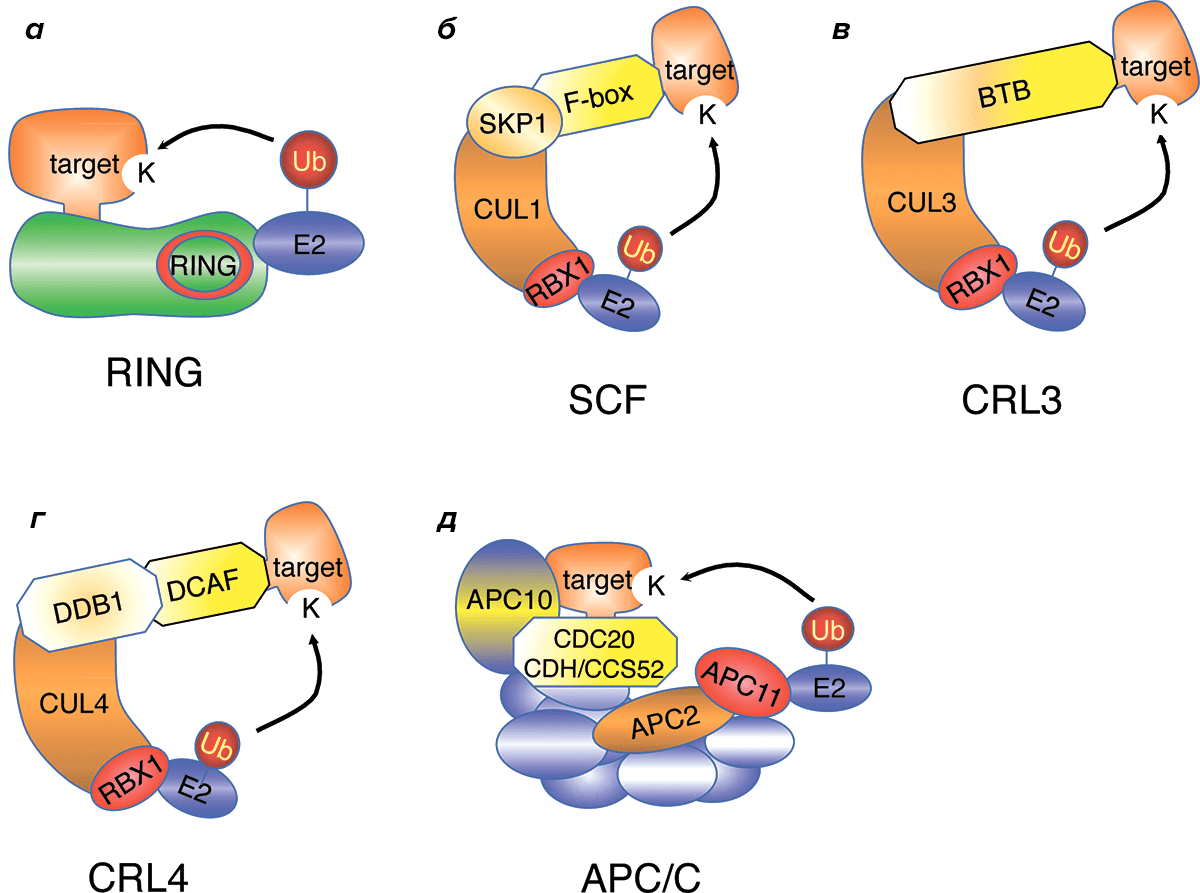
Ключевой частью системы протеасомы выступают ферменты, помечающие белки полиубиквитином. Существуют три группы ферментов, участвующие в этом процессе. E1-ферменты активируют убиквитин и переносят его на убиквитинконъюгирующий фермент E2. Наиболее многочисленны белки E3, которые обеспечивают специфичное связывание комплекса E2 с мишенью для деградации и переносят на нее убиквитиновую метку. Именно их разнообразие позволяет очень точно регулировать время полужизни каждого белка в клетке (рис. 1) [12].
Рисунок 1. Разные классы убиквитинлигаз, вовлеченные в регуляцию клеточного цикла. Мономерные RING-лигазы (а) напрямую связывают убиквитинконъюгирующий фермент E2 и мишень, в то время как SCF/CRL1, CRL3, и CRL4 (б–г) состоят из комплекса скаффолдных белков и RING-белка RBX1. APC/C (д) является огромным мультимерным комплексом, в который входят активирующие белки WD40, RING-доменный белок APC11 и другие.
История PROTAC
В 2001 году группы Реймонда Дешейза и Крейга Крюза придумали, как «натравить» систему протеасомной деградации на новые субстраты. Для этого они создали химерный пептид, состоящий из двух частей:
Получившаяся молекула работала как мостик, который связывал убиквитинлигазу E3 с ее новой мишенью. Исследователи увидели, что молекула не только физически сближает SCFβ-TRCP с новой мишенью, но и обеспечивает ее полиубиквитинилирование, а затем деградацию. Две особенности получившейся молекулы особо ценны:
Статья с описанием работы вышла в PNAS в 2001 году [7], и получившийся класс молекул окрестили PROTAC — proteolysis targeting chimera, или протеолиз-таргетированная химера. Авторы сразу предположили, что PROTAC можно использовать для терапии заболеваний, деградируя белки, участвующие в патогенезе, а также что можно деградировать белки только в определенных клетках и тканях, направляя к ним убиквитинлигазы, которые не синтезируются во всем организме. Однако они также отметили большое ограничение получившейся молекулы — пептидная конструкция не проникает в клетки сама собой.
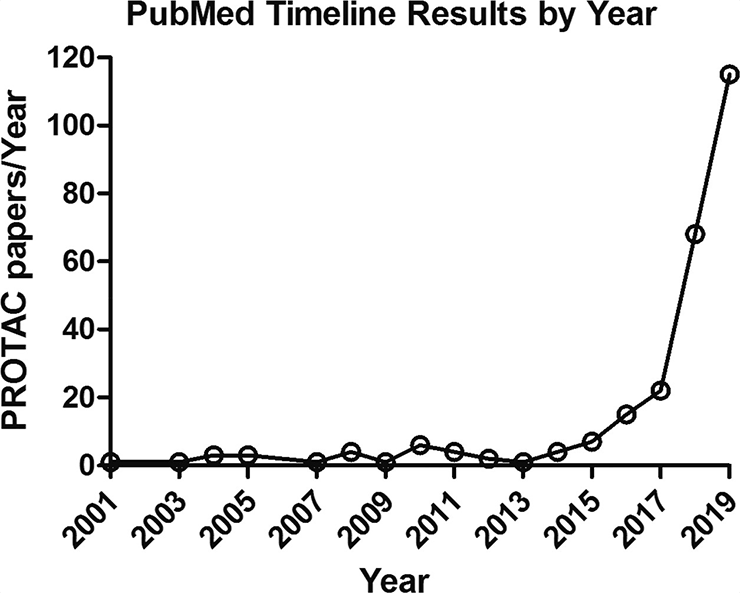
Рисунок 2. Динамика публикаций о PROTAC в Pubmed
Интерес к PROTAC был довольно скромным до 2015 года (рис. 2), однако затем область взорвалась десятками и сотнями статей [13]. Но для этого надо было решить проблему с доставкой в клетку и найти больше молекул, которые могут связывать E3-лигазы. Первый PROTAC, который мог проходить в клетку, был сделан той же парой Дешейза и Крюза, которые использовали пептид из транскрипционного фактора HIF-1α, субстрата E3-убиквитинлигазы VHL, помеченный поли-D-аргинином для проникновения в клетку. Полученный пептид мог направлять андрогеновый рецептор и белок FKBP12 на деградацию.
В лаборатории Крюза решили отойти от использования пептидов, и к 2008 году им удалось создать малую молекулу, которая позволяла деградировать андрогеновый рецептор [14]. Для этого они использовали селективный модулятор андрогеновых рецепторов (SARM), который эффективно связывался с рецептором. Второй частью молекулы был нутлин-3 — вещество, которое разрывало связь p53 c его убиквитинлигазой MDM2, связываясь с последней (рис. 3). Две части соединили ПЭГ-линкером, и получившаяся молекула работала внутри клетки, хотя и с не очень высокой активностью.
Вторым классом E3-лигаз, для которого были найдены низкомолекулярные ингибиторы, стали белки ингибиторы апоптоза IAP и XIAP, у которых также есть убиквитинлигазная активность. Ингибиторы этих белков разрабатывались как антиапоптотические белки, однако их конъюгация с мишенями позволила получить эффективные деградирующие химеры (названные SNIPER [15]).
Коммерциализация и начало клинических испытаний
Молекулы, связывающие убиквитинлигазу VHL, также находились в разработке, и в 2012 году в лаборатории Крюза создали первую малую молекулу, которая могла связывать VHL. В том же 2012 году Крюз основал Arvinas — первую компанию, которая планировала использовать PROTAC в клинике.
Вещества, привлекающие E3-лигазы VHL и CRBN, стали самыми популярными платформами для разработки низкомолекулярных PROTAC. В течение нескольких лет, начиная с 2015 года, были получены PROTAC против эстрогенового рецептора, BCR-ABL, Brd4, разнообразных рецепторных тирозинкиназ и множества других онкологических мишеней. К 2021 году количество описанных PROTAC-молекул увеличилось до 1600, а число мишеней — до 100.
В 2015 году были основаны две другие компании, решившие сделать ставку на использование PROTAC: Kymera Therapeutics и C4 Therapeutics. Рост числа, разнообразия и активности PROTAC привлек внимание крупных фармацевтических компаний: Arvinas заключил партнерские соглашения с Merck и Genentech, C4 — с Roche, а Kymera — с Sanofi.
В 2019 году Arvinas начала первые клинические испытания PROTAC-молекулы ARV110, направленной против того же андрогенового рецептора, в том числе и с мутациями, устойчивыми к имеющимся ингибиторам этого рецептора (например энзалутамиду). Для того чтобы PROTAC достигли клиники, пришлось решить множество проблем с биодоступностью, стабильностью и другими параметрами. Огромные молекулы PROTAC нарушали множество устоявшихся правил медицинской химии (такие как правило пяти Липинского), вначале вызывая ужас технологов и сомнения в том, что эти молекулы могут реально работать в организме. Однако все эти проблемы были решены, и к концу 2021 года количество клинических испытаний PROTAC должно увеличиться до 15 [18].
Среди мишеней PROTAC множество популярных онкологических мишеней: упомянутый выше эстрогеновый и андрогеновый рецепторы; эпигенетические белки BRD4 и BRD9, которые считывают гистоновые метки [19]; транскрипционный фактор STAT3 и другие. Один из клинических кандидатов — DT2216, деградирующий антиапоптотический белок Bcl-xL, — иллюстрирует сильные стороны PROTAC по сравнению с обычными ингибиторами: в свое время разработка ингибиторов Bcl-xL приостановилась из-за того, что тромбоциты гибнут при инактивации Bcl-xL. Решение, ставшее возможным с использованием подхода PROTAC, основано на том, что DT2216 таргетирует этот белок к убиквитинлигазе VHL, которая не производится в тромбоцитах.
У молекул PROTAC обнаружились и неожиданные преимущества — они оказались гораздо активнее, чем простые ингибиторы тех же молекул, работая скорее как катализаторы деградации: после того, как мишень деградировала в протеасоме, PROTAC освобождается для нового раунда связывания. Еще одно преимущество — PROTAС, убирая сам белок (а не только его активность), часто влияют на неферментативные функции своих мишеней, например, на стабилизацию комплексов, в которые они входят. Так, опухолевые линии, не чувствительные к ингибиторам BRD9, оказались очень чувствительными к его деградации.
Кроме онкологических, PROTAC разрабатываются и для других заболеваний. В Kymera сосредоточены на мишенях, важных не только для опухолей, но и для иммунной системы, таких как IRAK4 и вышеупомянутый STAT3. У Arvinas есть ряд молекул, направленных на нейродегенеративные заболевания — в разработке находятся молекулы, деградирующие хантингтин, ɑ-синуклеин и тау-белок. В 2019 году вышло несколько работ, показывающих эффективность тау-направленных PROTAC на животных моделях болезни Альцгеймера [20].
К сожалению, первые результаты клинических испытаний ARV110 немного охладили энтузиазм по поводу PROTAC: несмотря на очень впечатляющие результаты в мышиной модели, лишь у двоих из 22 пациентов наблюдалось значительное сокращение объема опухоли, и у части пациентов — отсутствие дальнейшего прогрессирования заболевания. Однако больше половины пациентов (которые прошли множество предыдущих линий терапии) продолжают получать терапию, и окончательные результаты испытания еще не представлены. Другой претензией скептиков PROTAC является то, что для большинства мишеней, против которых показана активность, уже имеются обычные ингибиторы. Пока обещания найти PROTAC для белков, недоступных для «обычных» ингибиторов, остаются невыполненными.
Другие бифункциональные молекулы
Способность молекул PROTAC привлекать к мишени белок, который ранее с ней не связывался, вызвала интерес — можно ли нацеливать другие ферменты на белки-мишени. Прежде всего были получены молекулы, направляющие мишени на другие пути деградации.
Lysosomal-targeting chimera (LYTAC) и MoDE-A являются модифицированными антителами, которые связывают мишень вне клетки и затем поглощаются эндоцитозом, связываясь с рецепторами (CI-M6PR и ASGPR) через линкерную молекулу. Поглощенный таким образом комплекс из антитела и белка-мишени направляется в лизосому.
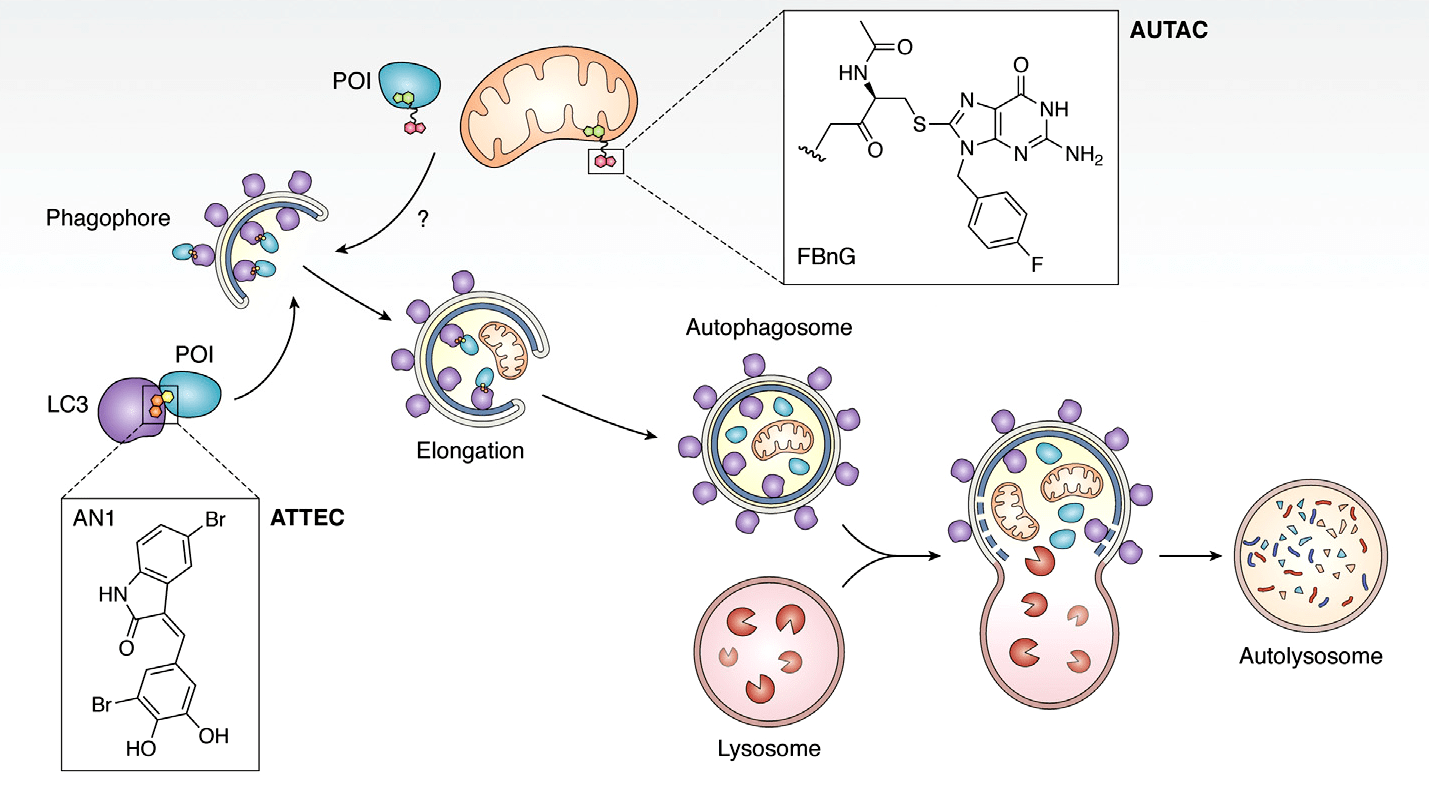
MADTAC-молекулы (macroautophagy degradation targeting chimeras, химера для направленной деградации макроаутофагией) используют еще один путь для деградации — аутофагию [21], [22]: ATTEC-молекулы (autophagosome-tethering compound, соединение, связывающее аутофагосомы) связывают мишень с LC3, компонентом мембраны аутофагосомы, в то время как AUTAC (autophagy-targeting chimera, химера для направленной аутофагии) направляют мишень в аутофагосому с помощью гуаниновой метки по неизвестному механизму [23]. AUTAC-молекулы могут помечать даже целые органеллы (например поврежденные митохондрии) для деградации (рис. 4).
Рисунок 4. Механизмы действия MADTAC (macroautophagy degradation targeting chimeras). ATTEC связывает белок-мишень и компонент аутофагосомы LC3. AUTAC-молекулы содержат гуаниновую метку, которая помечает мишень (в том числе целые органеллы) для включения в аутофагосому.
В 2019 году исследователи из Genentech сделали бифункциональную молекулу, привлекающую фосфатазу к мишени. Получившийся класс назвали PhoRC [24]. Обратный процесс позволяет направить киназы для фосфорилирования новых мишеней (эти вещества названы PHIC [25]). РНК-связывающие лиганды можно совместить с молекулой, привлекающей РНКазу L, получив RIBOTAC [26], [27]. Многие из этих молекул выглядят скорее как научные игрушки, чем клинические кандидаты, но и сами PROTAC вначале не казались похожими на реальные лекарственные молекулы.
Заключение
PROTAC представляет собой одну из удивительных историй успеха современной фармакологии. Всего за 20 лет эти вещества прошли от первоначальной идеи до множества реальных клинических кандидатов. PROTAC создал новую парадигму в медицинской химии, открыв новые принципы воздействия на мишень и существенно расширив горизонты возможного для низкомолекулярных соединений, связанные не только с ингибированием ферментов. И хотя нельзя предсказать, насколько эти молекулы будут клинически эффективны, в ближайшие годы их явно ждет большое будущее.
Партнер спецпроекта — компания Cytiva
1 апреля 2020 г. в результате приобретения подразделения GE Healthcare за 21,4 млрд долларов компанией Danaher Corporation была создана компания Cytiva. Cytiva аккумулировала в себе наследие передовых инноваций и разработок в таких областях, как очистка белка, одноразовые технологии, а также клеточная и генная терапии.
Ведущими брендами Cytiva являются: ÄKTA, Amersham, Biacore, FlexFactory, HyClone, KUBio, MabSelect, Whatman, Xuri, Xcellerex.
Компания Cytiva — номер один в очистке антител.
Cytiva оперирует в 40 странах и регионах, охватывая Европу, Азию, Северную и Латинскую Америки, а также Ближний Восток. Тысячи сотрудников занимаются развитием и ускорением разработки и производства терапевтических препаратов.
Во всем мире используется 100 000 систем компании Cytiva, а также более 60 установок технологических платформ «ФлексФактори».
Cytiva имеет 15 производственных площадок, 11 клиентоориентированных объектов, которые помогут масштабировать процесс от идеи до коммерческого производства, 7 глобальных складов, а также 6 учебных центров.
Ви́дение Cytiva — это мир, в котором доступ к жизненно важным методам лечения трансформирует здоровье человека. Являясь надежным партнером для клиентов различных масштабов и уровней, компания Cytiva повышает эффективность исследований и производственных процессов, обеспечивая разработку, производство и поставку революционных и инновационных препаратов для пациентов.
С использованием технологий Cytiva производится 75% утвержденных FDA биофармпрепаратов.
Посетите наш сайт www.cytivalifesciences.com для получения дополнительной информации.
Материал предоставлен партнёром — компанией Cytiva
Протеолиз это распад белки на меньшие полипептиды или аминокислоты. Некатализированный, гидролиз из пептидные связи происходит очень медленно и занимает сотни лет. Протеолиз обычно катализированный по сотовой связи ферменты называется протеазы, но также может происходить при внутримолекулярном пищеварении. Низкий pH или высокие температуры также могут вызывать неферментативный протеолиз.
Протеолиз в организмах служит многим целям; Например, пищеварительные ферменты расщепляют белки в пище, чтобы обеспечить организм аминокислотами, в то время как протеолитическая обработка полипептидной цепи после ее синтеза может быть необходима для производства активного белка. Это также важно для регуляции некоторых физиологических и клеточных процессов, а также для предотвращения накопления нежелательных или аномальных белков в клетках. Следовательно, нарушение регуляции протеолиза может вызвать заболевание. Протеолиз используется некоторыми яды.
Протеолиз важен как аналитический инструмент для изучения белков в лаборатории, а также в промышленных условиях, например, при переработке пищевых продуктов и удалении пятен.
Содержание
Биологические функции
Посттрансляционный протеолитический процессинг
Ограниченный протеолиз полипептида во время или после перевод в синтез белка часто встречается у многих белков. Это может включать удаление N-концевой метионин, сигнальный пептиди / или превращение неактивного или нефункционального белка в активный. Предшественник окончательной функциональной формы белка называется пропротеин, и эти пропротеины могут быть сначала синтезированы как препропротеины. Например, альбумин сначала синтезируется как препроальбумин и содержит нерасщепленный сигнальный пептид. Это образует проальбумин после отщепления сигнального пептида, и дальнейшая обработка для удаления пропептида с 6 N-концевыми остатками дает зрелую форму белка. [1]
Удаление N-концевого метионина
Удаление сигнальной последовательности
Белки, которые должны быть нацелены на конкретную органеллу или для секреции, имеют N-концевой сигнальный пептид который направляет белок к его конечной цели. Этот сигнальный пептид удаляется протеолизом после их транспорта через мембрана.
Расщепление полипротеинов
Некоторые белки и большинство эукариотических полипептидных гормонов синтезируются в виде большого полипептида-предшественника, известного как полипротеин, который требует протеолитического расщепления на отдельные более мелкие полипептидные цепи. Полипротеин проопиомеланокортин (ПОМК) содержит много полипептидных гормонов. Однако характер расщепления POMC может варьироваться в разных тканях, давая разные наборы полипептидных гормонов из одного и того же полипротеина.
Много вирусы также продуцируют свои белки первоначально в виде единой полипептидной цепи, которая транслируется с полицистронный мРНК. Этот полипептид впоследствии расщепляется на отдельные полипептидные цепи. [1] Общие названия полипротеина включают: кляп (группоспецифический антиген) в ретровирусы и ORF1ab в Нидовиралес. Последнее название относится к тому, что скользкая последовательность в мРНК, кодирующей полипептид, вызывает рибосомальный сдвиг рамки, что приводит к двум разным длинам пептидных цепей (а и ab) при приблизительно фиксированном соотношении.
Расщепление белков-предшественников
В частности, протеазы синтезируются в неактивной форме, так что они могут безопасно храниться в клетках и быть готовыми к высвобождению в достаточном количестве, когда это необходимо. Это необходимо для того, чтобы протеаза активировалась только в правильном месте или контексте, поскольку неправильная активация этих протеаз может быть очень разрушительной для организма. Протеолиз зимогена дает активный белок; например, когда трипсиноген раскалывается на форму трипсинпроисходит небольшая перестройка белковой структуры, которая дополняет активный центр протеазы, тем самым активируя белок.
Следовательно, протеолиз может быть методом регулирования биологических процессов путем превращения неактивных белков в активные. Хорошим примером является каскад свертывания крови при этом начальное событие запускает каскад последовательной протеолитической активации многих специфических протеаз, что приводит к свертыванию крови. В система комплемента из иммунная реакция также включает в себя сложную последовательную протеолитическую активацию и взаимодействие, которые приводят к атаке вторгающихся патогенов.
Деградация белков
Расщепление белка может происходить внутриклеточно или внеклеточно. При переваривании пищи пищеварительные ферменты могут выделяться в окружающую среду для внеклеточное пищеварение посредством чего протеолитическое расщепление расщепляет белки на более мелкие пептиды и аминокислоты, так что они могут абсорбироваться и использоваться. У животных пища может обрабатываться внеклеточно в специализированных органы или кишки, но у многих бактерий пища может усваиваться через фагоцитоз. Микробное разложение белка в окружающей среде можно регулировать доступностью питательных веществ. Например, ограничение основных элементов в белках (углерод, азот и сера) вызывает протеолитическую активность гриба. Neurospora crassa [3] а также в сообществах почвенных организмов. [4]
Белки в клетках расщепляются на аминокислоты. Это внутриклеточное разложение белка выполняет несколько функций: оно удаляет поврежденный и аномальный белок и предотвращает их накопление. Он также служит для регулирования клеточных процессов, удаляя ферменты и регуляторные белки, которые больше не нужны. Затем аминокислоты можно повторно использовать для синтеза белка.
Лизосома и протеасома
Опосредованный убиквитином процесс является избирательным. Белки, подверженные деградации, ковалентно связаны с убиквитином. Многие молекулы убиквитина могут быть связаны вместе с белком, предназначенным для разложения. Полиубихнированный белок нацелен на АТФ-зависимый протеазный комплекс, протеасому. Убиквитин высвобождается и используется повторно, в то время как целевой белок разрушается.
Скорость деградации внутриклеточного белка
В N-конец правило может частично определять период полужизни белка, а белки с сегментами, богатыми пролин, глютаминовая кислота, серин, и треонин (так называемой Белки PEST) имеют короткий период полураспада. [6] Другие факторы, предположительно влияющие на скорость разложения, включают скорость дезаминирования глутамина и аспарагин и окисление цистеин, гистидини метионин, отсутствие стабилизирующих лигандов, присутствие присоединенных углеводных или фосфатных групп, наличие свободной α-аминогруппы, отрицательный заряд белка, а также гибкость и стабильность белка. [5] Белки с большей степенью внутреннее расстройство также имеют короткий период полураспада в клетках, [7] с неупорядоченными сегментами, которые были предложены для облегчения эффективного инициирования деградации протеасома. [8] [9]
Скорость протеолиза может также зависеть от физиологического состояния организма, такого как его гормональное состояние, а также статус питания. Во время голодания скорость деградации белка увеличивается.
Пищеварение
В человеческом пищеварение, белки в пище расщепляются на более мелкие пептидные цепи пищеварительные ферменты такие как пепсин, трипсин, химотрипсин, и эластазаи в аминокислоты различными ферментами, такими как карбоксипептидаза, аминопептидаза, и дипептидаза. Необходимо расщепить белки на небольшие пептиды (трипептиды и дипептиды) и аминокислоты, чтобы они могли всасываться в кишечнике, а абсорбированные трипептиды и дипептиды также далее расщепляются на аминокислоты внутриклеточно, прежде чем они попадут в кровоток. [10] Различные ферменты имеют разную специфичность к субстрату; трипсин, например, расщепляет пептидную связь после положительно заряженного остатка (аргинин и лизин); химотрипсин расщепляет связь после ароматического остатка (фенилаланин, тирозин, и триптофан); эластаза расщепляет связь после небольшого неполярного остатка, такого как аланин или глицин.
В бактериях используется аналогичная стратегия использования неактивного зимогена или презимогена. Субтилизин, который производится Bacillus subtilis, продуцируется в виде препросубтилизина и высвобождается только в том случае, если сигнальный пептид расщеплен и произошла автокаталитическая протеолитическая активация.
Сотовая регуляция
Протеолиз также участвует в регуляции многих клеточных процессов путем активации или деактивации ферментов, факторов транскрипции и рецепторов, например, в биосинтезе холестерина, [11] или опосредование передачи сигналов тромбина через рецепторы, активируемые протеазой. [12]
Некоторые ферменты в важных точках контроля метаболизма, такие как орнитиндекарбоксилаза, полностью регулируются скоростью синтеза и скоростью разложения. Другие быстро разрушающиеся белки включают белковые продукты протоонкогенов, которые играют центральную роль в регуляции роста клеток.
Регуляция клеточного цикла
Апоптоз
Каспасы являются важной группой протеаз, участвующих в апоптоз или запрограммированная гибель клеток. Предшественники каспазы, прокаспаза, могут быть активированы протеолизом через его ассоциацию с белковым комплексом, который образует апоптосома, или гранзим B, или через рецептор смерти пути.
Автопротеолиз
Автопротеолиз происходит в некоторых белках, в результате чего пептидная связь расщепляется в самокатализирующемся внутримолекулярная реакция. В отличие от зимогеныэти автопротеолитические белки участвуют в реакции «единого оборота» и не катализируют дальнейшие реакции после расщепления. Примеры включают разрыв связи Asp-Pro в подмножестве фактор фон Виллебранда домены типа D (VWD) [14] [15] и Neisseria meningitidis Самостоятельная обработка домена FrpC, [16] разрыв связи Asn-Pro в Сальмонелла Белок FlhB, [17] Иерсиния Белок YscU, [18] а также расщепление связи Gly-Ser в подмножестве доменов белка спермы морского ежа, энтерокиназы и агрина (SEA). [19] В некоторых случаях автопротеолитическому расщеплению способствует конформационный штамм пептидной связи. [19]
Протеолиз и болезни
Аномальная протеолитическая активность связана со многими заболеваниями. [20] В панкреатитутечка протеаз и их преждевременная активация в поджелудочной железе приводит к самоперевариванию поджелудочная железа. Люди с сахарный диабет могут иметь повышенную лизосомальную активность, а деградация некоторых белков может значительно возрасти. Хронические воспалительные заболевания, такие как ревматоидный артрит может включать высвобождение лизосомальных ферментов во внеклеточное пространство, которые разрушают окружающие ткани. Аномальный протеолиз и образование пептидов, которые агрегируют в клетках, и их неэффективное удаление могут привести к многим возрастным неврологическим заболеваниям, таким как Альцгеймерас. [21]
Протеазы могут регулироваться антипротеазы или ингибиторы протеазы, а дисбаланс между протеазами и антипротеазами может приводить к заболеваниям, например, к разрушению тканей легких в эмфизема вызванный курение табак. Считается, что курение увеличивает нейтрофилы и макрофаги в легких, которые выделяют чрезмерное количество протеолитических ферментов, таких как эластаза, так что они больше не могут подавляться змеи такие как α1-антитрипсин, что приводит к разрушению соединительных тканей в легких. Другие протеазы и их ингибиторы также могут быть вовлечены в это заболевание, например матричные металлопротеиназы (MMP) и тканевые ингибиторы металлопротеиназ (ТИМПы). [22]
Другие заболевания, связанные с аберрантным протеолизом, включают: мышечная дистрофия, дегенеративные кожные заболевания, респираторные и желудочно-кишечные заболевания, и злокачественная опухоль.
Неферментативный протеолиз
Белковые скелеты очень стабильны в воде при нейтральном pH и комнатной температуре, хотя скорость гидролиза различных пептидных связей может варьироваться. Период полураспада пептидной связи в нормальных условиях может составлять от 7 до 350 лет, даже выше для пептидов, защищенных модифицированным концом или внутри белка. [23] [24] [25] Однако скорость протеолиза может быть значительно увеличена за счет экстремальных значений pH и тепла.
Некоторые химические вещества вызывают протеолиз только после определенных остатков, и их можно использовать для выборочного расщепления белка на более мелкие полипептиды для лабораторного анализа. [28] Например, цианоген бромид расщепляет пептидную связь после метионин. Подобные методы могут использоваться для специального расщепления триптофанил, аспартил, цистеинил, и аспарагинил пептидные связи. Кислоты, такие как трифторуксусная кислота и муравьиная кислота может использоваться для расщепления.
Как и другие биомолекулы, белки могут расщепляться только под действием высокой температуры. При 250 ° C пептидная связь может легко гидролизоваться, а ее период полураспада снижается примерно до минуты. [26] [29] Белок также может расщепляться без гидролиза через пиролиз; маленький гетероциклические соединения может начать формироваться при деградации. Выше 500 ° C, полициклические ароматические углеводороды может также образовывать, [30] [31] что представляет интерес для изучения генерации канцерогены в табачном дыме и приготовлении пищи на сильном огне. [32] [33]
Лабораторные приложения
Протеолиз также используется в исследовательских и диагностических целях:
Ферменты протеазы
Протеазы можно классифицировать в соответствии с каталитической группой, входящей в его активный центр. [38]
Некоторые типы яда, например, вырабатываемые ядовитыми змеи, также может вызывать протеолиз. Эти яды, по сути, представляют собой сложные пищеварительные жидкости, которые начинают свою работу вне тела. Протеолитические яды вызывают широкий спектр токсических эффектов, [39] включая эффекты, которые: