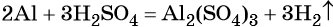Какие химические реакции протекают при эксплуатации автомобиля
Приведите примеры веществ, используемых при создании автомобиля, и химических реакций, протекающих при его эксплуатации
Обсуждение вопроса:
Используют различные металлы и сплавы (кузов), пластики (салон), резина (шины), стекло.
Сгорание бензина в двигателях внутреннего сгорания, а также серная кислота и свинец в аккумуляторе.
Примеры веществ, используемых при создании автомобиля:
• Оксид кремния (IV) (SiO₂) входит в состав автомобильных стекол.
• Железо (Fe) входит в состав стали.
• Алюминий (Al) применяется, например, для изготовления поршней для двигателя внутреннего сгорания.
• Резина применяется для изготовления автомобильных покрышек.
• Хром (Cr) применяют для хромирования деталей, которым нужно придать металлический блеск.
• Свинец (Pb) и серная кислота (H₂SO₄) используются для производства автомобильных аккумуляторов.
• Полипропилен используют для изготовления бачков омывателя.
• АБС-пластик (акрилонитрилбутадиенстирол) используется для изготовления отделки салона, производства бамперов и т. д.
• Поролон (полиуретан) используется для изготовления автомобильных сидений.
Примеры химических реакций, протекающих при эксплуатации автомобиля:
• Горение бензина: 2C₈H₁₈ + 25O₂ ⟶ 18H₂O + 16CO₂
• Коррозия железа: 4Fe + 3O₂ влага ⟶ 2Fe₂O₃
• Реакция в аккумуляторе между свинцом и его оксидом (IV) с серной кислотой: Pb + PbO₂ + 2H₂SO₄ ⟶ 2PbSO₄ + 2H₂O
Презентация по химии «ХИМИЯ и АВТОМОБИЛЬ»
Описание презентации по отдельным слайдам:
Химия Группа 121 Бескоровайный Никита и АВТОМОБИЛЬ
Аккумуляторная батарея (АКБ) Аккумуляторная батарея — источник постоянного тока, предназначенный для пуска двигателя стартером, для питания прочих потребителей при неработающем (или работающем на малых оборотах) двигателе. Аккумуляторная батарея преобразует химическую энергию в электричество, являясь источником электроэнергии автомобиля.
Устройство АКБ С точки зрения автомеханика…….
Состав аккумулятора Если разбить по процентной составляющей АКБ выходит примерно такой состав: 1) Свинец и его компоненты (оксиды и диоксиды) – порядка 60 – 70% от веса 2) Пластиковый корпус, перегородки и другие элементы ПВХ – 8 – 10% 3) Электролит (зачастую раствор серной кислоты) – 20% Так что получается нормально – если брать вес обычного 55 Амперного варианта, а он составляет порядка 15 кг. То металла должно быть – 15Х0,7= 10,5 кг, ПВХ – 15Х0,1= 1,5 кг и соответственно, электролит – 15Х0,2 = 3 кг
Электролит Раствор воды H2O и серной кислоты H2SO4 является электролитом, веществом проводящим электрический ток.
Электролит является опасной жидкостью! При изготовлении которой необходимо соблюдать технику безопасности!
Для предохранения от ожогов кожи, глаз и отравлений необходимо надевать кислотостойкий костюм, защитные очки, резиновые перчатки и сапоги, фартук из кислотостойкого материала.
АКБ и окружающая среда Одной из основных проблем на сегодняшний день является утилизация автомобильных аккумуляторов. Основные компоненты, входящие в состав аккумуляторных батарей, представляют большую опасность как для человека, так и для окружающей природы. Страшно представить, что может случиться с почвой при длительном контакте с электролитом или свинцом из выброшенного на свалку аккумулятора.
Вред АКБ на организм человека Свинец является токсичным металлом, который может попасть в организм при вдыхании свинцовой пыли или при прикосновении ко рту с руками, которыми до этого трогали свинец. Попадая в землю, частицы свинца загрязняют почву, и когда она просыхает, то попадают в воздух. Чрезмерное содержание свинца может повлиять на рост ребенка, вызвать повреждение головного мозга, повредить почки, ухудшают слух и приводить к поведенческим проблемам. Свинец также опасен для детей, которые еще только находятся в утробе матери. Взрослых, свинец может привести к потере памяти и к снижению способности концентрации внимания, а также нанести вред репродуктивной системе. Известно, что свинец вызывает повышенное кровяного давления, неврологические нарушения, и мышечные и суставные боли. Исследователи считают, что Людвиг ван Бетховен заболел и умер из-за отравления свинцом. Серная кислота в свинцово-кислотных батареях чрезвычайно агрессивна и потенциально более вредна, чем кислоты, используемые в других аккумуляторных системах. При попадании в глаза она может привести к постоянной слепоте; при проглатывании она повреждает внутренние органы, что может привести к смерти..
Утилизация АКБ Утилизация аккумуляторных батарей происходит на перерабатываемых предприятиях, имеющих всё необходимое оборудование. Процесс утилизации автомобильных аккумуляторов позволяет извлечь большое количество вторичного сырья: пластик, сталь, свинец и медь. Если на предприятие есть специальное оборудование, то и нейтрализованный электролит также можно использоваться повторно.
Вывод: Автомобиль тесно связан с химией; АКБ являясь источником электроэнергии автомобиля, преобразует химическую энергию в электричество; Основные компоненты, входящие в состав аккумуляторных батарей, представляют большую опасность как для человека, так и для окружающей природы; Каждому автомеханику необходимы знания в области химии.
Научная работа по педмету устройство автомобиля «Типы химический реакций»
Описание презентации по отдельным слайдам:
Типы химических,физическихреакций по предмету Устройство автомобиля Самбетов А.С. Преподаватель первой категории ГККП «Индустриально-технический колледж» Шымкент-2018
ВИДЫ ХИМИЧЕСКИХ РЕАКЦИЙ Химическая реакция Реакция горения Реакция разложения Реакция соединения Реакция замещения Реакция обмена Обратимая реакция
Что объединяет все эти реакции? В чём их отличие? Как мы можем назвать процесс, который протекает?
Химическая реакция — превращение одного или нескольких исходных веществ в отличающиеся от них по химическому составу или строению вещества (продукты реакции). CaO+H2O=Ca(OH)2 4HNO3=2H2O+4NO2+O2 CuSO4+Fe=FeSO4+Cu AgNO3+KBr=AgBr +КNO3 2SO2+O2 2SO3 4Fe(OH)2+2H2O+O2=4Fe(OH)3
Химические реакции происходят: при смешении или физическом контакте реагентов самопроизвольно при нагревании при участии катализаторов и светоэлектрического воздействия и т. п.
Все реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном, идет на образование новых химических связей.
Какие условия должны выполняться, чтобы произошла химическая реакция? Необходимо, чтобы реагирующие вещества соприкоснулись и чем больше площадь их соприкосновения, тем быстрее произойдет химическая реакция Некоторые реакции идут без нагревания, и только для некоторых реакций оно необходимо. Некоторые реакции протекают под действием электрического тока и света.
Реакция разложения одного сложного вещества с образованием несколько новых веществ, называется реакцией разложения. Например: 2KMnO4K2MnO4+ MnO2 + O2
Реакции соединения – химические реакции, в которых из двух или нескольких менее сложных по элементному составу веществ получается более сложное вещество Например: NH3 + CO2 + H2O =NH4HCO3
Реакция, протекающая между простыми и сложными веществами, при которой атомы простого вещества замещают атомы одного из элементов в сложном веществе, называется реакцией замещения. Zn + 2HCl = ZnCl2 + H2 2Fe +3H2O=Fe2O3+3H2
Реакция, протекающая между двумя сложными веществами, при которой атомы или группы атомов одного вещества замещают атомы или группы атомов другого вещества, называется реакцией обмена. CuO + H2SO4 = CuSO4 + H2O
Обратимые реакции химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном) Например: 3H2 + N2 ⇆ 2NH3
Задания вариантам: Внимательно прочитайте инструктивную карточку по проведению опыта. Соблюдая технику безопасности проведите химическую реакцию. Запишите уравнение реакции в тетрадь, укажите признаки прохождения реакции.
Курс повышения квалификации
Охрана труда
Курс профессиональной переподготовки
Библиотечно-библиографические и информационные знания в педагогическом процессе
Курс профессиональной переподготовки
Охрана труда
Ищем педагогов в команду «Инфоурок»
Номер материала: ДБ-1263324
Не нашли то что искали?
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
В Ленобласти педагоги призеров и победителей олимпиады получат денежные поощрения
Время чтения: 1 минута
Минобрнауки обновит перечень специальностей высшего образования
Время чтения: 1 минута
Для школьников к 1 сентября разработают короткие экскурсионные маршруты
Время чтения: 1 минута
Путин поручил не считать выплаты за классное руководство в средней зарплате
Время чтения: 1 минута
Утверждено стратегическое направление цифровой трансформации образования
Время чтения: 2 минуты
Учителям предлагают 1,5 миллиона рублей за переезд в Златоуст
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Приведите примеры веществ, используемых при создании автомобиля, и химических реакций, протекающих при его эксплуатации?
Приведите примеры веществ, используемых при создании автомобиля, и химических реакций, протекающих при его эксплуатации.
Используют различные металлы и сплавы (кузов), пластики (салон), резина (шины), стекло.
Сгорание бензина в двигателях внутреннего сгорания, а также серная кислота и свинец в аккумуляторе.
Что такое химические явления?
Что такое химические явления?
Приведите примеры веществ используемых при создании автомобиля, и химических реакций, протенкающих при его эксплотации?
Приведите примеры веществ используемых при создании автомобиля, и химических реакций, протенкающих при его эксплотации.
Как зависит скорость химических реакций : а) от катализатора ; б) от природы реагирующих веществ?
Как зависит скорость химических реакций : а) от катализатора ; б) от природы реагирующих веществ?
Химические реакции протекающие в живых организмах обеспечивают их нормальную жизнедеятельность.
Приведите примеры химических реакций, протекающих : А) при нагревании Б) под действием света?
Приведите примеры химических реакций, протекающих : А) при нагревании Б) под действием света.
Приведите примеры химических реакции в которых качественный состав веществ остается постоянным?
Приведите примеры химических реакции в которых качественный состав веществ остается постоянным.
Приведите примеры химических реакци, которые протекают : а)практически мгновенно б)медленно?
Приведите примеры химических реакци, которые протекают : а)практически мгновенно б)медленно.
Какая зависимость существует между скоростью химических реакций и концентрацией веществ?
Какая зависимость существует между скоростью химических реакций и концентрацией веществ.
Приведите конкретный пример.
Что такое химическое явления?
Что такое химическое явления?
Почему изменения агрегатного состояния вещества не является химической реакцией?
Приведите примеры химических реакций протекающих с выделением тепла?
Приведите примеры химических реакций протекающих с выделением тепла.
Смотри фото там всё подробно написано.
Среда водных растворов солей зависит от их гидролиза. Гидролизу не подвергаются соли, образованные сильной кислотой и сильным основанием (щелочью). Такие растворы солей имеют нейтральную среду. Соли, образованные сильным основанием и слабой кислот..
SO2 + H2O = H2SO3 соединение Zn + H2SO4 = ZnSO4 + H2 замещение 2NaOH + H2SO4 = Na2SO4 + 2H2O обмен.
1 яблоко, легкая задача.
Чем меньше длина связи и чем больше энергия связи, тем прочнее молекула.
Представлено решение. Названия написала иначе, но они соответствуют вашим в задании.
1. Веществами с ковалентной неполярной и металлической связью являются соответственно : 4)N2 и Pb 2. К хорошо растворимым в воде электролитам относится : 2) гидроксид натрия 3. Раствор нитрата цинка может реагировать с : 3)NaOH.
3) взаимодействие железа и раствора сульфата меди (II) ; Fe + Cu(NO3)2 = Cu + Fe(NO3)2 (в этой реакции окисляется железо и восстанавливается медь) 5) взаимодействие соляной кислоты и цинка. Zn + 2HCl = ZnCl2 + H2 (окисляется цинк и восстанавливается..
Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения. Сохранение массы веществ при химических реакциях
Химической реакцией называют взаимодействия, приводящие к изменению химической природы участвующих в них частиц. При этом происходит изменение их состава и (или) строения. В химических реакциях могут участвовать атомы, молекулы, ионы и радикалы.
В ходе химических реакций атомные ядра не затрагиваются и число атомов каждого химического элемента сохраняется.
Химические реакции протекают при определённых условиях (температура, давление, наличие или отсутствие растворителя, катализа, ультрафиолетовое излучение).
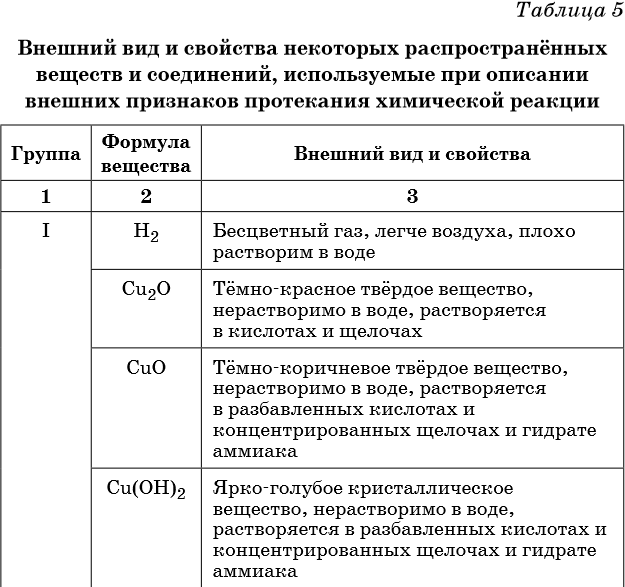
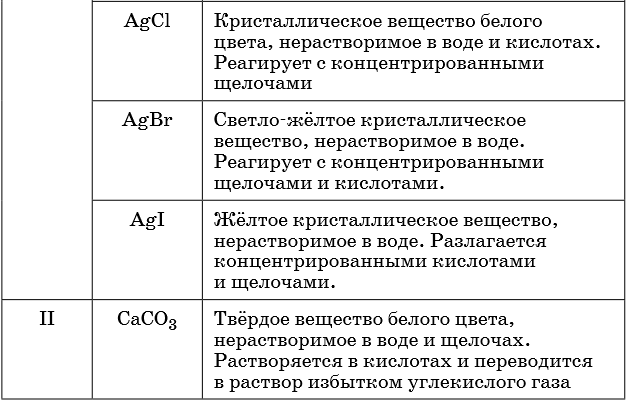
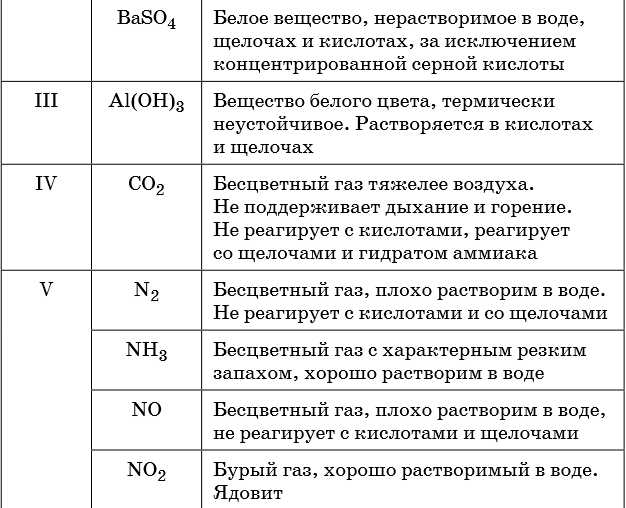
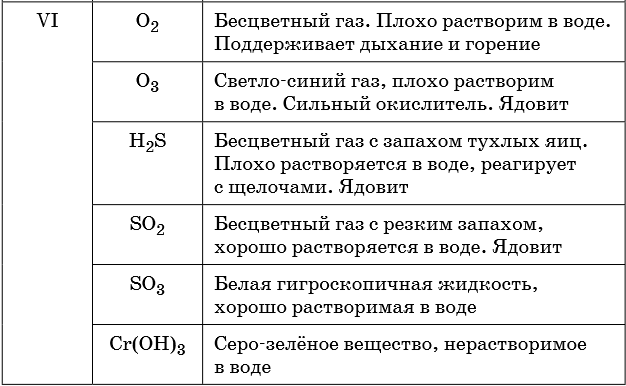
Признаками протекания химических реакций являются выделение или поглощение газа, образование или растворение осадка, изменение цвета, выделение или поглощение теплоты.
Описание качественных реакций, используемых для определения некоторых катионов и анионов, приводится в приложении в конце урока.
В таблице 5 представлены сведения о внешнем виде и свойствах некоторых распространённых веществ и соединений, используемых при описании внешних признаков протекания химической реакции.
Для описания химических реакций используют химические уравнения, в левой части которых указывают исходные вещества, а в правой — продукты реакции. Обе части химического уравнения соединяют стрелкой (в случае необратимых химических превращений), а если химическая реакция является обратимой, то это показывают с помощью прямой и обратной стрелок.
В неорганической химии, если количество атомов химических элементов в левой и правой частях уравнено с помощью стехиометрических коэффициентов, части уравнения часто соединяют знаком равенства.
Стехиометрией называют учение о количественных соотношениях между реагентами и продуктами реакции.
Коэффициенты стехиометрические — действительные натуральные (то есть положительные, как правило, целые) числа, стоящие перед формулой химического вещества в уравнении реакции. Коэффициенты показывают минимальное количество структурных единиц вещества (атомов, молекул, ионов, радикалов), участвующих в данной реакции.
В вышеприведённой реакции два атома алюминия реагируют с тремя молекулами серной кислоты, в результате чего образуется одна молекула сульфата алюминия (коэффициент, равный одному, перед формулой не ставят) и три молекулы водорода.
В соответствии с законом сохранения массы (закон Ломоносова — Лавуазье) масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Этот закон подтверждает, что атомы являются неделимыми и в ходе химических реакций не изменяются. Молекулы при реакциях претерпевают изменения, но общее число атомов каждого вида не изменяется, и поэтому общая масса веществ в процессе реакции сохраняется.
Тренировочные задания
1. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) растворение осадка
2) выделение чёрного осадка
3) отсутствие внешних признаков
4) выделение синего осадка
2. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) растворение осадка
3) выделение белого осадка
4) выделение синего осадка
3. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение жёлто-зелёного газа
3) выделение жёлтого осадка
4) растворение осадка
4. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) появление оранжевой окраски
2) выделение газа с характерным запахом
3) растворение осадка
4) отсутствие внешних признаков
5. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) отсутствие внешних признаков
3) выделение белого осадка
4) выделение чёрного осадка
6. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Zn и KOH
В) HCl и FeS
ПРИЗНАКИ РЕАКЦИИ:
1) выделение жёлтого осадка
2) выделение газа с характерным запахом
3) выделение бесцветного газа
4) выделение чёрного осадка
7. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
8. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
9. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение синего осадка
2) растворение осадка
3) выделение белого осадка
4) выделение бурого осадка
10. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) AgNO3 и NaI
Б) Al и NaOH
В) HCl и K2SO3
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка
11. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) отсутствие внешних признаков
12. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ВЕЩЕСТВА:
А) Cu и HNO3 (конц.)
Б) Cu и H2SO4 (конц.)
В) BaCO3 и HCl
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение бесцветного газа
13. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
14. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого осадка
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
15. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа
3) выделение белого осадка
4) выделение чёрного осадка
16. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение синего осадка
17. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) отсутствие внешних признаков
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение чёрного осадка
18. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) растворение осадка
19. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бесцветного газа
2) выделение бесцветного газа с характерным запахом
3) выделение белого осадка
4) выделение студенистого бесцветного осадка
20. Установите соответствие между реагирующими веществами и признаками протекающей между ними реакции.
ПРИЗНАКИ РЕАКЦИИ:
1) выделение бурого газа
2) выделение газа с характерным запахом
3) выделение белого осадка
4) выделение жёлтого осадка