фолликулы в матке что это такое
«Препаратов, улучшающих качество яйцеклеток, не существует». Что важно знать об овариальном резерве
Чем старше женщина, планирующая беременность, тем актуальнее для нее вопрос овариального резерва. Что влияет на качество яйцеклеток? Можно ли узнать их количество? И «экономятся» ли они во время беременности и кормления грудью?
На эти и другие вопросы ответила Лаура Константиновна Ольшанская, врач акушер-гинеколог первой квалификационной категории медицинского центра «ИдеалМед».
Что такое репродуктивное здоровье
Способность к деторождению тесно связана с понятием репродуктивного здоровья.
С понятием репродуктивного здоровья коррелирует и термин овариальный резерв. Разобраться в нем поможет детальное рассмотрение особенностей работы яичников.
Как работают яичники
Яичники — это парные женские половые железы, расположенные в полости малого таза. Это место, где созревают женские половые клетки — яйцеклетки. Также яичники являются железами внутренней секреции и, соответственно, вырабатывают половые гормоны.
Яичники состоят из двух слоев — поверхностного слоя (коркового) и мозгового вещества, в котором находятся фолликулы в разных стадиях развития и регресса.
Овариальный резерв можно оценивать по-разному.
Это маркер качества ооцитов (женских половых клеток, участвующих в размножении, — незрелых яйцеклеток, вырабатывающихся в яичнике).
Это маркер резерва фолликулов. Клиническая оценка происходит на 2-5 день цикла:
При количестве фолликулов от 8 до 20 говорят об умеренной и/или хорошей частоте наступления беременности.
Сколько яйцеклеток дано женщине
Каждая из женщин рождается с определенным запасом яйцеклеток. С 3-4 недели внутриутробного развития у эмбриона начинается закладка половых желез.
До 22 недель беременности их количество равно 4,5-5 млн, после чего снижается. К моменту рождения их количество составляет около 2 млн, к периоду полового созревания (11-13 лет) — 400 тысяч, к периоду менопаузы — 1000 единиц.
Их нельзя нарастить, пересадить, добавить. Их столько, сколько есть изначально, и становится меньше с каждым годом.
Из 400 тысяч фолликулов к моменту полового созревания только около 400 станут доминантными.
Это значит, что они смогут выпустить зрелую яйцеклетку, способную к оплодотворению. Остальные подвергнутся атрезии (запрограммированной гибели).
Жизненный цикл фолликулов
С самого рождения девочки ее яичники содержат ряд незрелых, первичных фолликулов, в которых находятся одинаково незрелые первичные ооциты. И для того чтобы яйцеклетка была готова к оплодотворению, она должна пройти стадии роста, «созревания» вместе с фолликулами — местом, где она «обитает».
Фолликул проходит 3 стадии роста и формирования:
То есть доминантный фолликул, видимый на УЗИ на 14-й день цикла, созревал не две недели, а целых 200 дней.
В естественном цикле у женщин вырастает один, крайне редко два доминантных фолликула. Параллельно с этим десяток фолликулов, которые могли бы стать, но так и не стали доминантными, просто погибают — подвергаются атрезии.
Овариальный резерв и ЭКО
Вопреки расхожему стереотипу, стимуляция овуляции при прохождении процедуры ЭКО не истощает запас яйцеклеток. Яйцеклетки, которые стимулируют, все равно бы «умерли» в течение естественного цикла в этом месяце.
Фолликулы, которые не прошли первые две стадии роста, нечувствительны к действию препаратов для стимуляции овуляции. Те же, которые уже чувствительны, все равно погибают или становятся доминантными вне зависимости от каких-либо факторов или препаратов.
Стимуляция овуляции не истощает овариальный резерв и не приближает климакс.
Фолликулогенез — непрерывный процесс, а значит, яичники в любое время содержат фолликулы на разных стадиях развития. Большинство фолликулов «умрет» и никогда не завершит весь цикл развития.
Как сохранить яйцеклетки
Единственный способ сохранить яйцеклетки — криоконсервация, то есть заморозка ооцитов.
Яйцеклетки стареют — так же, как и люди. После 35 лет повышается количество хромосомных аномалий. Частота наступления беременностей снижается, а частота выкидышей — возрастает.
Как только яйцеклетка стареет или «портится», ее невозможно восстановить. Препаратов, улучшающих качество яйцеклеток, не существует.
Яйцеклетка имеет очень короткий срок жизни. Как только она покидает яичник (период овуляции), она будет жить всего 12-24 часа. Вот почему время имеет решающее значение при планировании беременности.
Яйцеклетки очень нежные. Их нельзя просто заморозить, так как они повредятся кристаллами льда. Поэтому используются специальные методики мгновенной заморозки, при которой не успевает образоваться лед.
Для оценки состояния овариального резерва имеют значение:
Яйцеклетка не созревает: почему и что делать
Автор статьи Калинина Наталья Анатольевна Врач-репродуктолог, врач высшей категории, врач акушер-гинеколог
Зачатие происходит только в том случае, если яйцеклетка созрела и вышла из фолликула в брюшную полость. Этот процесс называется овуляцией, и обычно он приходится на середину цикла. Но в организме иногда бывают сбои, которые негативно отражаются на фертильности. Почему не созревает яйцеклетка, поможет установить высококвалифицированный гинеколог. Нарушения могут затрагивать различные звенья фолликулогенеза. И только грамотный подход к диагностике, проводимой на современном оборудовании, позволит разобраться в истинных причинах и механизмах ановуляции.
Как созревает яйцеклетка
Овуляция – это эндокринно-опосредованный процесс разрыва фолликула, который происходит примерно через 35-40 часов после подъема уровня лютеинизирующего гормона (ЛГ). Яйцеклетка должна выйти в брюшную полость и затем попасть в маточную трубу.
Подъем уровня лютеинизирующего гормона инициирует окончательное созревание женской половой клетки, которая будет готова к встрече со сперматозоидом. Одновременно с этим под влиянием ЛГ активируется синтез простагландинов. Эти вещества способствуют отделению яйценосного бугорка от стенки фолликула, а также способствуют растворению мембраны фолликула и ее разрыву. Если этого не происходит, то развивается синдром пустого фолликула. В этом случае при проведении ЭКО после пункции фолликула не удается получить яйцеклетку.
В норме яичник в фазе овуляции должен сблизиться с фимбриями маточной трубы, чтобы ооцит с легкостью туда мог попасть. Этот процесс могут нарушить спайки и рубцы, кисты, эндометриоидные очаги вследствие механического давления или посредством нарушения моторики маточной трубы.
Таким образом, процесс созревания фолликулов очень сложный. И только его грамотное моделирование, учитывающее физиологические особенности, может привести к желаемым результатам в рамках лечения эндокринного бесплодия.
Персонифицированный подход к каждой женщине центра репродуктивного здоровья «СМ-Клиника» позволяет добиваться наилучших терапевтических результатов. Врачи разбираются в каждом случае до мельчайших подробностей, отвечают на вопрос, может ли яйцеклетка не созреть, и выявляют факторы, которые этому способствуют, чтобы провести коррекцию имеющихся нарушений.
Как может повести себя фолликул
Созревание фолликула происходит в первой фазе менструального цикла. В норме этот процесс завершается овуляцией, при этом эндометрий становится достаточно толстым, чтобы в последующем быть в состоянии принять оплодотворенную яйцеклетку (после процесса секреторной трансформации).
Однако процесс фолликулогенеза может нарушиться. Основные варианты нарушения:
Во всех случаях нарушается репродуктивная функция женщины, и может развиваться эндокринное бесплодие.
Причины, по которым не созревает яйцеклетка
Основными причинами нарушенной овуляции являются эндокринные факторы – недостаточная активность щитовидной железы или гипофиза, который вырабатывает тропные гормоны, стимулирующие яичник. Также яйцеклетка не созревает правильно при повышенном уровне мужских половых гормонов или пролактина. Зачастую подобные эндокринные расстройства можно заподозрить по нарушению менструального цикла. У женщин месячные приходят нерегулярно, могут быть скудными или обильными.
Процесс выхода яйцеклетки из фолликула могут нарушать некоторые лекарственные препараты, которые отодвигают наступление овуляции или вовсе блокируют ее.
Естественные физиологические причины
Как ни странно это звучит, но даже в норме допускается отсутствие овуляции. В течение года может быть 2-3 менструальных цикла, которые не сопровождаются созреванием яйцеклетки и ее выходом из фолликула. Стоит отметить, что такое состояние является вариантом нормы только в том случае, если ановуляторные циклы не следуют один за другим.
Достаточно часто несозревание фолликула могут спровоцировать следующие состояния:
Патологии в органах малого таза
Основными патологиями в органах малого таза, при которых не созревает яйцеклетка, являются следующие:
Симптомы и диагностика
По клиническим симптомам бывает трудно догадаться, что яйцеклетка не созревает. Обычно подобные расстройства устанавливаются с помощью ультразвуковой оценки состояния эндометрия и яичников. На 8-9-й день менструального цикла в норме должен определяться доминантный фолликул, который увеличивается каждый день на 2-3 мм. Накануне овуляции его размер должен достигать 18-22 мм. Гранулезные клетки такого фолликула вырабатывают половые гормоны, преобладающим из которых в первую фазу цикла является эстрадиол. Он вызывает пролиферацию эндометрия, в результате чего слизистая утолщается и имеет типичную трехслойную структуру. Ближе к овуляции начинается рост желез – секреторная трансформация эндометрия, которая хорошо определяется с помощью ультразвука.
Заподозрить нарушенное созревание яйцеклетки помогают следующие симптомы:
- недостаточная толщина эндометрия; отсутствие трехслойной структуры и предовуляторных изменений; отсутствие доминантного фолликула или его малые размеры накануне овуляции.
Дополнительно для оценки фолликулогенеза может определяться концентрация в крови эстрадиола и лютеинизирующего гормона.
Когда необходима стимуляция овуляции
Стимуляция овуляции – это медикаментозное моделирование фолликулогенеза и проведение соответствующей подготовки эндометрия. Такое лечение показано тогда, когда овуляция не происходит или запаздывает. Достаточно часто синдром неовулировавшего фолликула подразумевает индукцию с помощью инъекций ХГЧ. Могут применяться и другие препараты (рекомбинантный лютеинизирующий гормон, антагонисты гонадолиберинов и т.д.). Оптимальный препарат гинеколог подбирает индивидуально каждой женщине после детального обследования.
После индукции овуляции пара должна совершить половой акт через 24-36 часов. Если уровень ЛГ в сыворотке крови уже повышен, то интимная близость должна состояться в день введения индуцирующего препарата.
Поле стимуляции овуляции гинеколог подбирает прогестероновый препарат для поддержания второй фазы менструального цикла. Это позволит подготовить эндометрий (вызвать секреторную трансформацию) для возможной имплантации оплодотворенной яйцеклетки.
Преимущества лечения в Центре репродуктивного здоровья «СМ-Клиника»
В многопрофильном холдинге центр репродуктивного здоровья «СМ-Клиника» прием ведут не только гинекологи, но и врачи других специальностей, задача которых «настроить» организм женщины на правильное функционирование и успешную реализацию репродуктивной функции. Диагностика выполняется с использованием оборудования экспертного класса, которое позволяет выявить даже незначительные отклонения в функциональном состоянии органов. В собственной лаборатории проводится оценка различных показателей, которые отражают состояние и функционирование репродуктивной системы.
Овариальный резерв

С другой стороны, в некоторых случаях встречаются женщины, у которых и в 25 лет отмечается наличие «некачественных» яйцеклеток, нуждающиеся даже в донорских яйцеклетках.
Эти крайние примеры, однако, вполне существующие, привели к необходимости того, что стало нужным каким-то образом оценивать количество и качество яйцеклеток у женщин различных возрастных групп. Именно с этой целью и было введено понятие «овариальный резерв», поскольку возникла необходимость оценивать репродуктивный возраст женщины, не как абсолютное число лет со дня ее рождения, а как ее реальную существующую способность к беременности.
Овариальный резерв – это количество яйцеклеток у женщин в данный момент времени, которые могут быть использованы для оплодотворения.
Но как их посчитать, они же находятся в яичниках? С это целью предложен ряд функциональных тестов, о которых Вы немного сможете узнать в этом разделе.
Подсчет количества антральных фолликулов

Таким образом, подсчет антральных фолликулов, видимых при ультразвуковом исследовании, заменяет микроскопическое исследование яичников для точной оценки количества предшественников яйцеклеток.
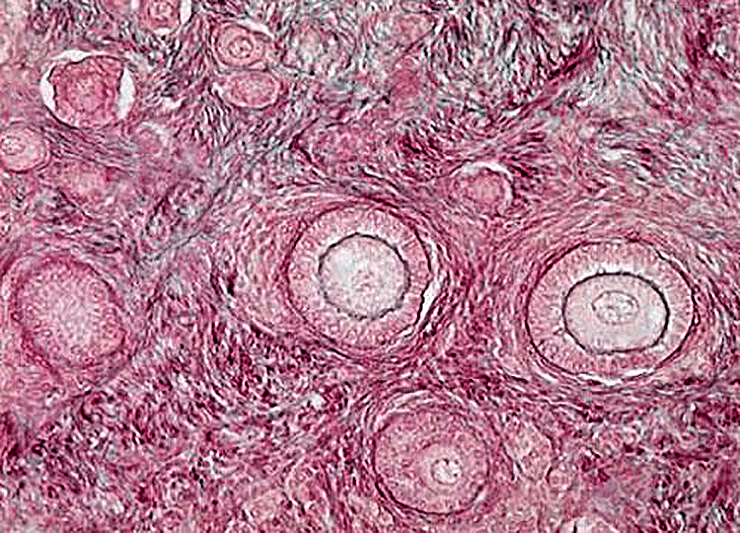
На рисунке 1 слева изображен яичник (обведен синим), в котором произведен подсчет антральных фолликулов в начале менструального цикла (отмечены красным). В данной проекции яичника видно 16 таких фолликулов.
Какие же количество антральных фолликулов является «хорошим»?
По ряду исследований зарубежных авторов выявлена следующая закономерность:
Количество антральных фолликулов
Ожидаемый ответ на стимуляцию овуляции и эффективность методик ВРТ
Очень низкое количество. Бедный или отсутствие ответа на стимуляцию. Серьезно следует рассмотреть вопрос о включении в программу ЭКО. Очень низкая вероятность наступления беременности.
Низкое количество. Возможен незначительный ответ на стимуляцию. Преимущественно использование очень высоких доз ФСГ для стимуляции. Неудачные попытки.
Несколько сниженное количество. Большое количество неудачных попыток.
Нормальное (но среднее) количество. Ответ на стимуляцию сниженный, но, как правило, достаточный. Группа с благоприятным прогнозом для наступления беременности.
Нормальное хорошее количество. Отличная реакция на стимуляцию овуляции. Предпочтительно использование невысоких доз ФСГ. Наилучшая эффективность.
Высокое количество, характерное для синдрома поликистозных яичников. Необходимо использование низких доз, в связи с риском синдрома гиперстимуляции. В некоторых случаях яйцеклетки низкого качества, что снижает вероятность беременности.
Содержание фолликулостимулирующего гормона (ФСГ) на 2-3 день менструального цикла.
Этот показатель также является важным маркером состояния овариального резерва.
По отечественным данным выделяют следующие границы концентраций:
Вычисление объема яичника
Формула для расчета объема яичника следующая:
Объем яичника = 0,532 х длина х ширина х толщина.
Содержание антимюллерова гормона (АМГ) и ингибина В.
Наиболее информативным является тест, который позволяет определять содержание антимюллерова гормона. У женщин выработка этого гормона осуществляется в гранулезных клетках и достигает максимума в преантральных и антральныхх фолликулах 4 мм в диаметре.
В фолликулах большего размера, а также в фолликулах более 8 мм в диаметре, секреция этого вещества отсутствует.
На рисунке 2 схематично представлены действия АМГ в яичнике:
Схематично изображен рост фолликулов. Показано, что антимюллеров гормон продуцируется первичными и преантральными фолликулами и имеет преимущественно 2 типа воздействия на яичник: 1 – подавляет первичные стадии роста фолликулов, 2- подавляет ФСГ-зависимый рост и селекцию преантральных и небольших антральных фолликулов.
На основании ряда исследований установлено, что содержание АМГ в сыворотке крови напрямую связано с содержанием антральных фолликулов, то есть на основании данных анализа можно проводить оценку состояния овариального резерва. Показано также, что, чем ниже содержание этого гормона в крови, тем хуже ответ яичников на проводимую стимуляцию овуляции.
Интересен тот факт, что антимюллеров гормон может быть использован не только для оценки состоянии овариального резерва, но также и для оценки патофизиологического состояния яичников, например, для подтверждения наличия поликистоза яичников, поскольку при этом заболевании увеличен пул именно антральных фолликулов небольшого размера. Этот показатель может не только являться маркером наличия заболевания, но также и критерием, который позволит оценивать тяжесть нарушений при поликистозе яичников.
Исследование содержания антимюллерова гормона можно проводить в любой день цикла, поскольку его содержание в течение цикла практически не изменяется. По данным других ученых, исследование содержания антимюллерова гормона лучше проводить на 3-5 день цикла. Эти данные могут быть использованы при подготовке к проведению ВРТ с целью объективной оценки состояния яичников, а также выбора правильного протокола стимуляции.
На основании оценки ряда вышеперечисленных показателей можно сделать заключение о состоянии овариального резерва женщины:
Низкий овариальный резерв предполагается, если:
Высокий овариальный резерв предполагается, если:
Прорыв в лечении бесплодия
Прорыв в лечении бесплодия
Овуляция и дальнейшее оплодотворение возможны при наличии в яичниках женщины абсолютно жизнеспособных фолликулов
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Процент женщин, лишенных радости материнства, с каждым годом возрастает. Среди причин бесплодия всё чаще выделяют первичную недостаточность яичников (ПНЯ). Данная патология заключается в отсутствии фолликулов или нарушении их созревания в ответ на гормональную стимуляцию. Решение проблемы эндокринного бесплодия вследствие синдрома истощения яичников предложили ученые из США и Японии. Им удалось активировать фолликулы яичников в условиях in vitro и имплантировать фрагменты ткани в верхний отдел фаллопиевых труб, что дает женщине шанс стать матерью.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучшее новостное сообщение».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Корни проблемы
Яичник — уникальная эндокринная система, в которой ежемесячно возникает новая секреторная структура — граафов фолликул (рис. 1). Он развивается из микроскопического примордиального фолликула, потенциальная функциональность которого и определяет регулярность менструального цикла женщины.
Рисунок 1. Фолликулы яичников
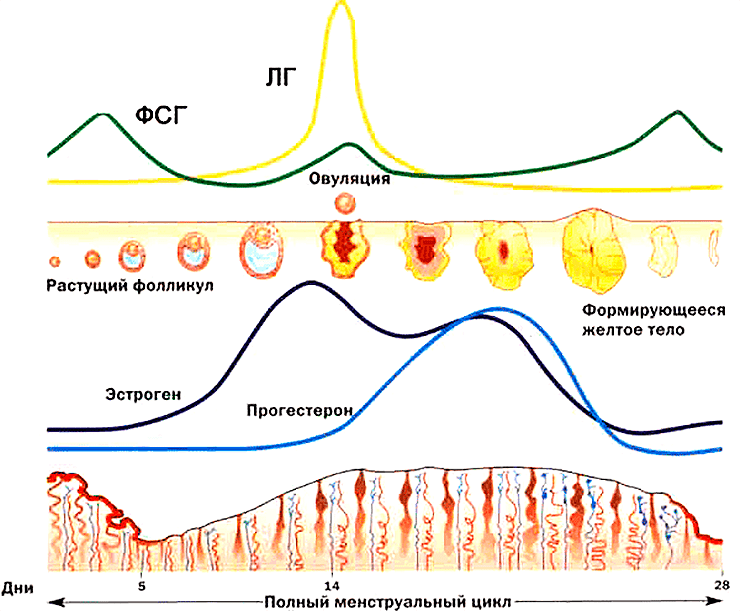
Функция яичников регулируется двумя гормонами гипофиза: фолликулостимулирующим гормоном (ФСГ) и лютеинизирующим гормоном (ЛГ) (рис. 2). В свою очередь, яичники продуцируют гормоны, регулирующие секрецию ФСГ и ЛГ по принципу отрицательной обратной связи: эстрогены, ингибины и прогестерон [1].
Рисунок 2. ФСГ стимулирует рост и созревание фолликула в яичнике. ЛГ стимулирует выход созревшей яйцеклетки из фолликула (овуляцию).
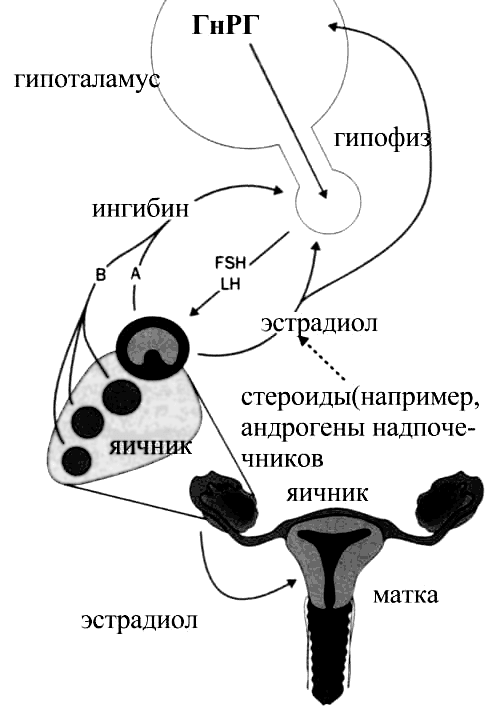
При недостаточности функции яичников для поддержания снижающейся концентрации яичниковых гормонов происходит резкое повышение секреции гонадотропинов. За их выработку отвечает гипоталамус (рис. 3).
Рисунок 3. Связь функционирования яичников с эндокринной системой
Причины, приводящие к развитию первичной недостаточности яичников (ПНЯ), весьма гетерогенны: генетические, ферментативные, аутоиммунные, инфекционно-токсические, психогенные. Кроме того, в эту группу относят и дефекты в структуре гонадотропинов. В последние годы большое внимание исследователей уделяется молекулярно-генетическим аспектам этой патологии яичников, поскольку выявлен определенный набор генов, который может отвечать за развитие ПНЯ.
Стоит отметить, что термин «первичная недостаточность яичников» в настоящее время применяется для определения состояния, которое ранее называли «преждевременной менопаузой». Ключевое различие заключается в том, что термин «ПНЯ», предложенный еще в 1942 году, характеризует нарушение функции яичников в динамике, а не конечное состояние, что наблюдается при менопаузе [1].
Диагностика
Яичниковая недостаточность диагностируется по повышенному уровню ФСГ и ЛГ в крови при сниженном уровне эстрогенов. Самый чувствительный гормон — ФСГ; он является самым ранним маркером преждевременного старения яичников. При двукратном превышении уровня ФСГ (20 Ед/л) наступление и благополучный исход беременности маловероятны.
Клинические характеристики состояния: аменорея (отсутствие менструации) ≥4 месяцев у женщин моложе 40 лет, бесплодие и повышение уровня ФСГ до менопаузальных значений (дважды с промежутком не менее 1 месяца).
Частота спонтанной недостаточности яичников у женщин с хромосомным набором 46 ХХ составляет около 1%; при этом эпидемиологические исследования указывают на тесную связь данного нарушения с возрастом. Так, у женщин в возрасте до 20 лет ПНЯ встречается с частотой 1:10000, а в возрасте от 30 до 40 — 1:1000.
Что происходит на гормональном уровне
Один из половых гормонов — 17β-эстрадиол (рис. 4), который играет важную роль в выполнении репродуктивной функции женщины, — вырабатывается преимущественно в яичниках из мужских половых гормонов — андростендиона и тестостерона [2]; небольшое количество этого гормона также вырабатывается надпочечниками. В процессе угасания функций яичников количество растущих фолликулов в них уменьшается, что приводит к значительному понижению выработки 17β-эстрадиола. Поэтому у женщин с так называемым синдромом истощения яичников наблюдается нехватка этого гормона, которая частично компенсируется большей выработкой 17β-эстрадиола в надпочечниках. Так как менструации становятся нерегулярными, уровень 17β-эстрадиола начинает колебаться, и с прекращением менструаций резко понижается, что приводит к повышению фолликулостимулирующего гормона (ФСГ).
Рисунок 4. β-эстрадиол (кристаллы). Поляризация LM X100.
Механизм активации незрелых фолликулов
Для женщин, страдающих бесплодием по причине рассмотренного заболевания, существует единственная возможность материнства — имплантация оплодотворенной донорской яйцеклетки. Однако группа специалистов из Стэнфордского университета (США) и Медицинского факультета Университета им. Святой Марианны (Япония) предложили альтернативу — метод, позволяющий исключить известные хирургические вмешательства для стимуляции овуляции, такие как клиновидная резекция яичников или лазерное сверление. Врачи удалили яичники у участниц исследования, поделили их на несколько частей, а затем воздействовали на фрагменты яичников препаратами, стимулирующими рост. Спустя несколько дней некоторые из фрагментов ткани были имплантированы в фаллопиевы трубы женщин. Затем специалисты наблюдали за развитием фолликулов. У некоторых участниц исследования сформировались зрелые яйцеклетки, что позволило провести им стандартную процедуру экстракорпорального оплодотворения (ЭКО [3]). Результаты исследования опубликованы в журнале Proceedings of the National Academy of Sciences [4].
Важно отметить, что возможность провести подобное лечение возникла благодаря изучению сигнального клеточного пути под названием Hippo [5], который представляет собой один из ключевых компонентов регуляции таких важных процессов, как контактное ингибирование роста клеток и связанного с ним контроля размера внутренних органов [6]. Первоначально белковый комплекс Hippo был открыт у дрозофил. Мухи, у которых его функционирование было нарушено, буквально увеличивались в размерах (из-за чего регулятор и получил своё название: «Hippo» происходит от слова «гиппопотам»). Затем его обнаружили и у млекопитающих.
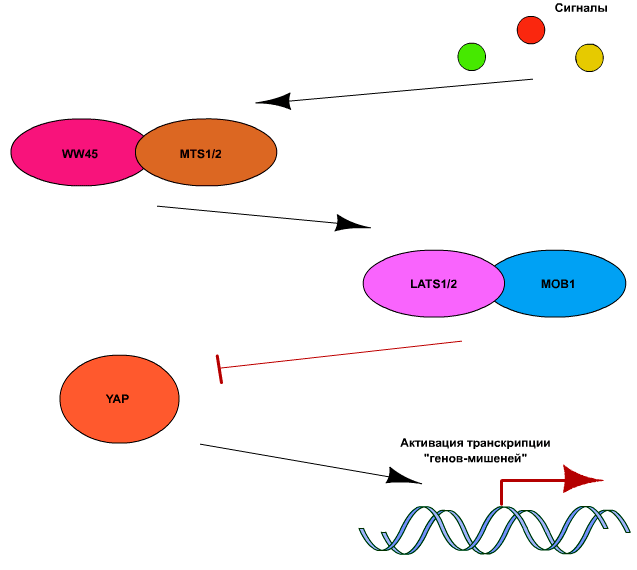
Ключевым компонентом пути Hippo является киназа Yap (Yes-activated protein), которая в активном состоянии способна связывать ряд факторов транскрипции, таких как p73, p53-binding protein-2 (p53BP2), RUNX2, SMAD7, ERBB4, PEBP2а и TEAD/ТЕF [7]. Регуляция активности YAP осуществляется в основном за счет ингибирующего действия киназ LATS1 и 2 (large tumor supressor-1 и −2). Они, в свою очередь, активируются киназами МSТ1 и МSТ2 (mammalian sterile-20-like kinases). Для полной активации LATS и МSТ необходимо также, чтобы они были связаны с адапторными белками WW45 и МОB1, соответственно. Вышеописанная часть сигнального пути Hippo является высококонсервативной у млекопитающих, в то время как сигналы активации или ингибирования LATS и МSТ могут быть достаточно разнообразными. В общих чертах сигнальный путь Hippo представлен на рис. 5.
Рисунок 5. Схематичное изображение работы сигнального белкового регулятора Hippo
Развитие эмбриона, деление эмбриональных клеток и рост тканей и органов эволюционно контролируются работой различных регуляторов. По словам одного из авторов исследования Арона Сюэ (Aaron Hsueh) — акушера-гинеколога из Стэнфордского Университета в Калифорнии — у женщин с синдромом истощения яичников наблюдается повышенная активность регулятора Hippo [8]. Другими словами, он блокирует созревание практически всех фолликулов яичника, что минимизирует возможность наступления овуляции и дальнейшего оплодотворения.
Ученые нарушили работу сигнального пути Hippo в удаленных яичниках и, таким образом, предотвратили преждевременную остановку развития фолликулов. Далее специалисты стимулировали активность другого сигнального пути, называемого Akt, что способствовало ускорению роста фолликулов [9], [10].
Клинические исследования проводились сначала на лабораторных животных. На следующем этапе в эксперименте согласились принять участие 27 женщин, страдающих от первичной дисфункции яичников. В ходе исследования выяснилось, что у некоторых женщин в яичниках не было фолликулов. В яичниках 13 пациенток обнаружили незрелые фолликулы; из них у восьми женщин применение нового метода лечения способствовало росту жизнеспособных фолликулов. Для 14 женщин лечение оказалось неэффективным.
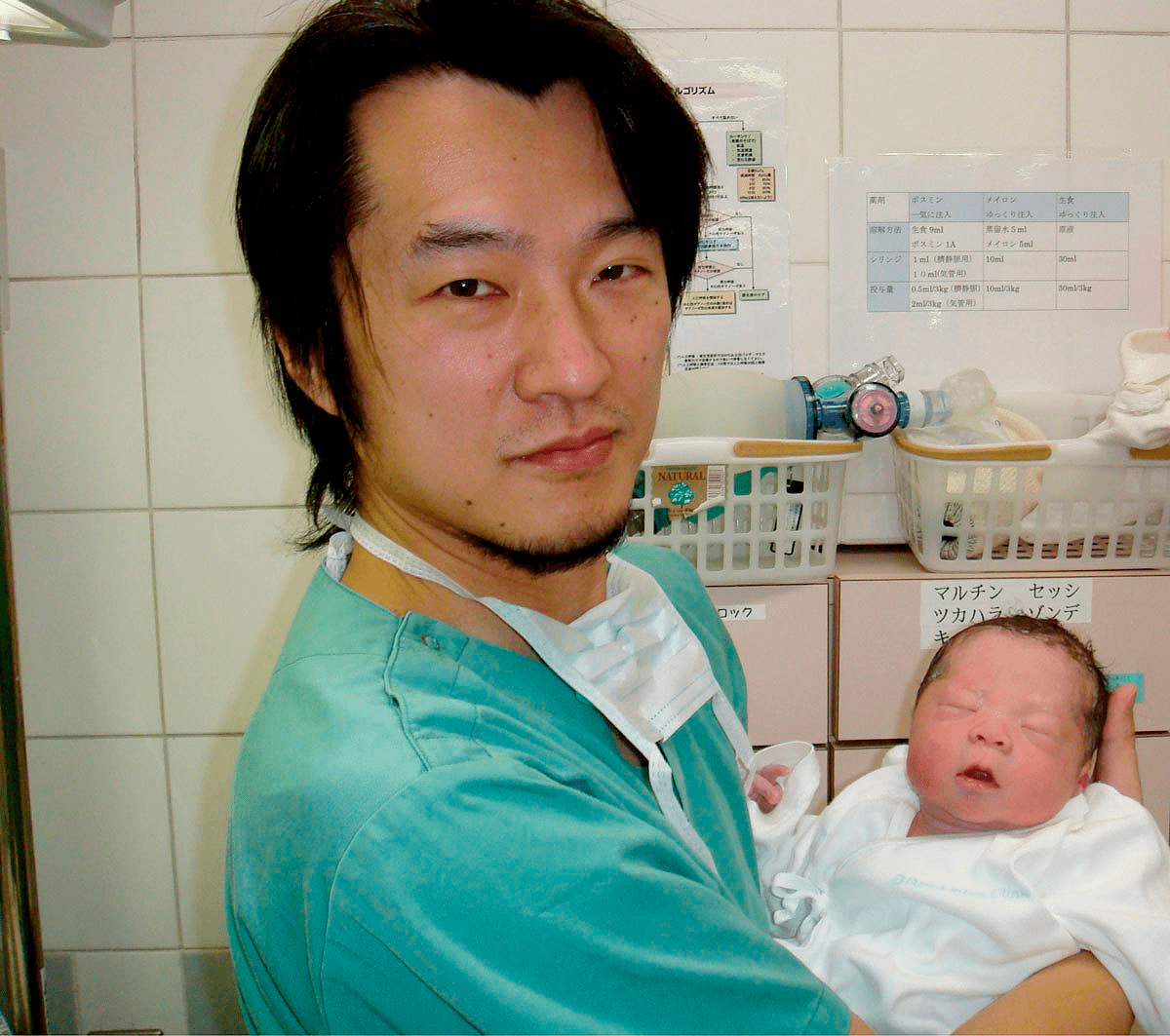
В результате зрелые яйцеклетки были получены у пяти женщин и использованы для ЭКО. Одна из пациенток в возрасте 29 лет во время курса лечения на 37 неделе беременности родила ребенка весом 3,3 кг (рис. 6). Научная группа надеется, что эффективность нового метода лечения достигнет 30%. И, более того, по их словам, этот метод может также помочь женщинам, перенесшим лучевую или химиотерапию, и пациенткам в возрасте лет с нерегулярным менструальным циклом [11].
Рисунок 6. Казухиро Кавамура (Kazuhiro Kawamura) — один из ученых, участвовавший в исследовании — держит на руках новорожденного мальчика, которого родила первоначально бесплодная женщина
Мнения и прогнозы
По мнению Марчелле Цедарса (Marcelle Cedars) — специалиста в области репродуктивной онкологии из Университета Калифорнии в Сан-Франциско — исследователи поторопились апробировать новый метод лечения бесплодия на человеке: «Ученые продемонстрировали рождение здорового потомства при проведении предварительных исследований на мышах, но не было получено доказательств роста, развития и/или плодовитости этого поколения» [12].
Авторы исследования полагают, что метод подходит бесплодным женщинам среднего возраста, а также тем, кому диагностировали первичную недостаточность яичников, вследствие которой в более чем 50% случаев беременность не наступает. Однако не все эксперты разделяют их оптимизм. Руководитель врачебной группы, изучающей оплодотворение, из Университета Южной Калифорнии Ричард Паульсон (Richard Paulson) убежден, что ключевое условие эффективности разработанного механизма лабораторной «активации» фолликула — наличие в нем здоровой яйцеклетки. Кроме того, Паульсон заостряет внимание на том, что неразумно сопоставлять результаты лечения женщины в возрасте 29 лет с результатами лечения женщины в 40 лет, поскольку гормональная стимуляция роста и развития фолликулов в разные возрастные периоды происходит с различной интенсивностью.
Рассмотренный консервативный метод стимуляции овуляции путем блокировки сигнального пути Hippo в отдельных фрагментах ткани яичников может быть полезен женщинам, больным раком или проходящим процедуры стерилизации. Но все же главное достижение ученых — это рождение ребенка у женщины, которая без их участия никогда не смогла бы стать матерью.