фетальная печень что такое
Фетальная печень что такое
ДЛЯ ТОГО ЧТОБЫ СКАЧАТЬ СТАТЬЮ В ФОРМАТЕ PDF ВАМ НЕОБХОДИМО АВТОРИЗОВАТЬСЯ, ЛИБО ЗАРЕГИСТРИРОВАТЬСЯ
Фетальная печень человека [ФПЧ] является уникальным органом, в котором содержатся стволовые кроветворные клетки и их ком-митированные потомки различной степени зрелости. В настоящей работе проведено определение содержания иммунокомпетентных клеток в ФПЧ 9-10 недель гестации по фенотипическим свойствам и реакции на митогены, а также исследовано влияние клеток ФПЧ на пролиферацию лимфоцитов периферической крови взрослых доноров при совместном культивировании.
Суспензию клеток ФПЧ получали неферментативным методом с использованием вибрации. Клетки криоконсервировали под защитой 5% ДМСО со скоростью 1 и/мин. Фенотипический анализ проводили с использованием флуоресцентной микроскопии. Пролиферативную активность клеточных культур ФПЧ и лимфоцитов периферической крови (ЛПК> взрослых доноров определяли по включению 3Н-тимидина. В смешанной культуре клетки ФПЧ совместно культивировались с ЛПК в присутствии или отсутствие митогенов.
Введение
В связи с этим в настоящей работе проведено опре деление содержания иммунокомпетентных клеток в ФПЧ 9 10 недель гестации по фенотипическим свойствам и ре акции на митогены, а также исследовано влияние клеток ФПЧ на пролиферацию лимфоцитов периферической крови взрослых доноров при совместном культивировании.
Материал и методы
Фрагменты печени плодов человека 9 10 недель геста ции получали после искусственного прерывания беременное ти с письменного согласия проинформированных доноров. Суспензию клеток ФПЧ получали в стерильных условиях неферментативным методом с использованием вибрации (3], модифицированным для малых объемов. Полученную клеточную суспензию фильтровали через устройства для пе реливания кровезаменителей и использовали для дальней ших исследований либо криоконсервировали.
Подсчет количества клеток проводили в камере Горяе ва, жизнеспособность до и после криоконсервирования оп ределяли по окрашиванию трипановым синим. Определе ние а фетопротеина (АФП) проводили иммуноферментным методом с помощью набора «Вектор Бест», Новосибирск, Россия) согласно инструкции производителя на планшетном спектрофотометре Tecan GENios (Австралия).
Для криоконсервирования суспензию клеток разводили до концентрации 2×106/мл и по каплям добавляли равный объем криозащитной среды, содержащей 10% диметил сульфоксида (ДМСО). Суспензию эквилибрировали с крио протектором при 4°С в течение 15 мин., после чего замора живали в контейнере Nalgene Mr. Frosty (Sigma, США) три этапа: до температуры 40°С со скоростью 1 °/мин, затем до 80°С со скоростью 10°/мин. Суспензии клеток хранили в жидком азоте не менее 3 х месяцев, а непосредственно перед исследованиями отогревали на водяной бане при средой культивирования, содержащей 10% эмбриональной сыворотки крупного рогатого скота (ЭС), и центрифугиро вали при 200 g в течение 10 мин. Осадок суспендировали в 1 мл среды.
Лимфоциты периферической крови (ЛПК) человека выделяли в градиенте Ficoll Paque (Pharmacia, Швеция) согласно протоколу (4).
Для проведения фенотипического анализа клетки иммо билизировали на предметном стекле с помощью 10% ра створа поли L лизина, окрашивали моноклональными ан тителами и, по мере необходимости, фиксировали 4% раствором параформальдегида. В работе использовали моноклональные антитела к: CD3, CD4, CD8, CD20, CD45, HLF DR, HLA ABC. Наблюдение и количественный анализ клеток, меченных вторичными антителами, конъюгирован ными с FITC, проводили под флуоресцентным микроскопом Jenaval (Karl Zeiss, Йена, Германия).
Для исследования пролиферативной активности клетки суспендировали в среде RPM11640, содержащей 10% ЭС, 50 ед/мл пенициллина и 50 мг/мл стрептомицина и по x в течение 48 часов, после чего в лунки добавляли по 1 ^Ci раствора 3Н тимидина. Образцы инкубировали в тех же условиях в течение 24 часов. Включение 3Н тимидина в ДНК клеток определяли на сцинтилляционном р спектрометре S7800 Beckman (США). Данные выражали в импульсах в минуту (имп/мин).
Для определения влияния митогенов на интенсивность пролиферации клеток ФПЧ клетки культивировали с фито гемагглютинином (ФГА, 20 мкг/мл) или конканавалином А (Кон А, 10 мкг/мл). В некоторых экспериментах пролифе рацию клеток ФПЧ ингибировали обработкой митомицином С (МТМ С) в конечной концентрации 25 мкг/мл, после чего МТМ С трижды отмывали средой RPMI 1640.
Для постановки смешанной культуры клетки ФПЧ и лим фоциты периферической крови совместно культивировали в соотношении 1:1 в течение 48 часов, после чего в лунки вносили 3Н тимидин и определяли интенсивность его вклю чения через 24 часа.
Полученные результаты обрабатывали статистически; в зависимости от характера распределения использовали параметрический метод (t критерий Стьюдента) или непа раметрический Вилкоксона (5 ].
Результаты и обсуждение
Жизнеспособность свежевыделенной первичной сус пензии клеток ФПЧ, оцененная по окрашиванию трипано вым синим, составляла 85±2%. Иммунофенотипический анализ первичной суспензии не выявил зрелых В и Т лим фоцитов (CD3, CD4, CD8, CD20). Единственными предста вителями клеток лимфоидного ряда были CD45 позитивные клетки, количество которых составляло 2,09±0,32%. Однако о зрелости этих клеток сложно судить, учитывая, что CD45 экспрессируется не только на зрелых лимфоцитах, но и на лимфоидно коммитированных клетках, а также на кроветвор ных клетках предшественниках (6 ]. Проведенный анализ не исключает присутствия в суспензии клеток ФПЧ незрелых предшественников Т лимфоцитов, способных дифференци роваться тимус независимым путем при культивировании или трансплантации (14).
В связи с этим была предпринята попытка выявить функ ционально активные Т лимфоциты в фетальной печени че ловека при совместном культивировании клеток ФПЧ с митогенами и аллоантигенами. Известно, что фитогемаг глютинин (ФГА) и конканавалин А (Кон А) активируют Т лимфоциты, избирательно связываясь с углеводными компонентами клеточных мембран (7]. В связи с этим, ис следовали влияние этих митогенов на включение 3Н тими дина в ДНК клеток ФПЧ (рис. 1).
Из рис.1, видно, что ФГА и Кон А не только не активи ровали клетки ФПЧ, но даже подавляли их пролиферацию. При этом ФГА достоверно (р
Ультразвуковые исследования печени в педиатрии
Введение
Клиническая анатомия печени
Известно высказывание, сравнивающее ультразвуковые исследования (УЗИ) с волшебным фонариком, позволяющим заглянуть в темную комнату и рассмотреть ее содержимое. УЗИ представляют нам «живую анатомию» органа, позволяя поставить топический диагноз при очаговом поражении печени или объективно охарактеризовать динамику диффузного процесса.
а) Вид с диафрагмальной поверхности.
б) Вид с абдоминальной поверхности.
а) Левая доля печени.
б) Правая доля печени.
Полноценное УЗИ подразумевает неукоснительную визуализацию ветвей воротной вены, их сегментарных ветвей, печеночных вен. Это позволяет диагностировать не только очаговые поражения печени, но и обнаружить тромбозы, сдавление сосудов объемным образованием или прорастанием опухоли в сосуд. Допплеровское исследование завершает диагностическую процедуру, определяя наличие и направление кровотока в сосудах. Рядом с сосудистым пучком (печеночная артерия и воротные вены) располагаются желчные ходы. Они становятся видны при блокаде оттока желчи [2].
Клинические проблемы
Желтухи новорожденных могут быть результатом паренхиматозных процессов (гепатоцеллюлярные) обструктивного характера, гемолитического и септического происхождения.
УЗИ сканер HS60
Профессиональные диагностические инструменты. Оценка эластичности тканей, расширенные возможности 3D/4D/5D сканирования, классификатор BI-RADS, опции для экспертных кардиологических исследований.
Химиоэмболизация печени
Химиоэмболизация печени (называемая также трансартериальной химиоэмболизацией, сокращенно ТАХЭ) – это эндоваскулярный хирургический метод, позволяющий приостановить рост раковой опухоли путем остановки кровотока в питающей опухоль артерии в сочетании с подведением к раковым узлам химиопрепаратов. Химиоэмболизация печени принадлежит к процедурам интервенционной хирургии.
Специфика методики состоит в использовании препаратов сразу двух типов, вводимых в сосуд:
Преимущества химиоэмболизации
Благодаря своей специфике химиоэмболизация, во-первых, наносит «двойной удар» по раковой опухоли. Во-вторых, она дает возможность, используя химиопрепарат в высоких, эффективных дозах, минимизируя при этом вред, наносимый его токсичным эффектом организму в целом. Это обусловлено тем, что при химиоэмболизации химиопрепарат не попадает в системный кровоток – эмболизирующий препарат обеспечивает его доставку непосредственно к раковому узлу.
С учетом того, что рак печени, в отличие от ряда других онкологических заболеваний, практически не восприимчив к системной химиотерапии и химиопрепараты в борьбе с ним эффективны только тогда, когда вводятся в саму печеночную артерию, химиоэмболизация печени дает существенные преимущества.
Одна из главных опасностей злокачественных опухолей печени заключается в том, что рано или поздно они приводят к острой почечной недостаточности, и именно она становится во многих случаях причиной летального исхода. С помощью химиоэмболизации можно не только остановить рост опухоли, но и поддерживать приемлемое качество жизни пациента, сохраняя способность печени функционировать на достаточном уровне.
Химиоэмболизация печени хорошо сочетается с другими методами локальной деструкции злокачественной опухоли – стереотаксической лучевой терапией и радиочастотной аблацией – и ее можно проводить повторно по необходимости, что делает ТАХЭ важной частью комплексной борьбы с раком печени. Может применяться химиоэмбользация и как самостоятельный метод.
В каких случаях проводится химиоэмболизация печени
Проведение химиоэмболизации возможно как при первичном (холангиокарцинома, гепатоцеллюлярная карцинома), так и при метастатическом раке печени. Метастатические очаги в печеночной ткани как правило возникают при раке легких, толстой кишки, молочной железы и простаты.
Важно понимать, что химиоэмболизация является локальным вспомогательным, не радикальным, методом в борьбе с раком печени. Цель ТАХЭ заключается в том, чтобы затормозить рост опухоли, уменьшить ее размеры и позволить печени продолжить функционировать, продлив тем самым жизнь пациенту.
Отправьте документы на почту cc@nacpp.ru. Возможность проведения лечения рассмотрит главный врач клиники Антон Александрович Иванов, онколог-хирург, кмн
Химиоэмболизацию рекомендуют в тех случаях:
Медицинский директор, врач онколог-хирург, к.м.н
Противопоказания для химиоэмболизации печени
Химиоэмболизация обычно не рекомендуется при следующих состояниях:
Также существует ряд случаев, в которых эффективность ТАХЭ потенциально сомнительна:
В отдельных случаях химиоэмболизация может проводиться, несмотря на риски, со сниженной дозой эмболизирующего препарата.
Виды химиоэмболизации печени
На данный момент существуют в общей сложности три вида химиоэмболизации.
При масляной химиоэмболизации, которая начала применяться еще в 80-х годах, в питающий опухоль сосуд вводится масляный рентгеноконтрастный препарат, в котором в свою очередь заключен химиопрепарат. Однако масляный раствор не может блокировать кровоток непосредственно в опухолевой ткани, и с его помощью крайне сложно добиться необходимой высокой концентрации химиопрепарата, доставленного к опухоли. По этой причине эффективность этого вида ТАХЭ довольно низкая. Но его преимущество заключается в том, что масляная химиоэмболизация может быть проведена даже при 70% поражения печеночной ткани. Через полтора – два месяца масляная ТАХЭ проводится повторно. Количество необходимых повторных процедур обычно не менее трех.
В начале XXI века появилась методика химиоэмболизации микросферами. Изобретенные эмболизирующие препараты на основе микросфер, накапливающих, а затем высвобождающих химиопрепарат, позволили повысить доставляемую к опухоли концентрацию химиопрепарата. Именно это делает ТАХЭ микросферами существенно более эффективным видом. Повторная процедура при необходимости возможна уже через 4 недели. Однако данный вид химиоэмболизации применим только в случае, если область поражения не больше 50%.
Нам доверяют 9500 пациентов ежегодно.
Также возможно проведение комбинированной ТАХЭ. Она представляет собой сочетание двух описанных выше видов химиоэмболизации. Сначала производится ТАХЭ микросферами, а на втором этапе можно применить на остаточной опухоли масляную химиоэмболизацию.
Препараты для химиоэмболизации печени
В настоящее время химиоэмболизацию печени микросферами проводят двумя препаратами: DC Bead и Hepaspheres.
Микросферы DC Bead, производящегосябританской компанией Biocompatibles, изготовлены из поливинилалкоголя. Они могут иметь диаметр от 100 до 900 микрон: каждый вариант размера соответствует диаметру сосуда, в котором нужно перекрыть кровоток. Доксорубицин – основной применяемый для ТАХЭ химиопрепарат – высвобождается из микросфер DC Bead в течение двух недель.
В Hepaspheres, выпускаемом американской Biosphere Medical, микросферы состоят из сополимера винилацетата и метилакрилата. Химиопрепарат тот же, что и в DC Bead, – доксорубицин. Hepaspheres выпускается с микросферами 30–60, 50–100, 100–150 или 150–200 микрон в диаметре. В воде размер микросфер увеличивается в 4 раза.
Медицинский директор, врач онколог-хирург, к.м.н
Как проводится химиоэмболизация печени
Как правило, химиоэмболизация проводится под общим наркозом, но также возможно и погружение пациента в состояние седации. С помощью специальных датчиков контролируются артериальное давление и сердечный ритм пациента.
Через небольшой надрез в верхней части бедра в бедренную артерию вводится катетер. Следя за продвижением с помощью рентгена, катетер подводят к печеночной артерии. Когда катетер достигает ее, через него вводится рентгеноконтрастный раствор, позволяющий оценить расположение сосудов. Когда кончик катетера оказывается непосредственно в ветви артерии, питающей опухоль, вводится эмболизирующий препарат вместе с химиопрепаратом.
После этого делаются рентгеновские снимки, чтобы удостовериться, что препарат введен правильно. Затем катетер извлекается, на место разреза накладывается повязка.
Длится ТАХЭ около 1–1,5 часов. Для снижения риска возникновения осложнений применяются
Эффективность химиоэмболизации печени
Для оценки результата проведенной химиоэмболизации через 4 недели после первой процедуры делается КТ или МРТ с контрастированием сосудов. Если в сосудах отсутствует контрастное вещество, это означает гибель опухолевых клеток. Через полтора – два месяца производится вторая процедура с контрольным обследованием.
Если контрастное вещество проходит в сосуды, осуществляется повторная процедура с контрольным обследованием уже через 4 недели, чтобы не растягивать интервал между второй и третьей процедурой.
Эффективность химиоэмболизации довольно высока: примерно в 2/3 случаев удается заметно сократить размеры опухоли или вовсе остановить ее рост. В зависимости от типа рака эффект цикла ТАХЭ сохраняется в течение 10–14 месяцев.
Если через полгода после цикла химиоэмболизации рост опухоли возобновляется, ТАХЭ можно повторить.
Согласно клиническому исследованию, проведенному в Барселоне с участием 27 пациентов, цикл химиоэмболизации печени продлил жизнь на год 92% людей, на два — 89%. Выживаемость в течение трех лет после цикла ТАХЭ, по результатам исследования 71 пациента в Афинах, — 76,4%. Для ряда пациентов ТАХЭ становится возможностью дождаться своей очереди на трансплантацию.
Осложнения после химиоэмболизации печени
Возможные осложнения после химиоэмболизации могут быть связаны либо с токсичностью химиопрепарата, либо с селективной сосудистой манипуляцией. В большинстве случаев побочные эффекты ограничиваются подташниванием, болевыми ощущениями в месте катетеризации сосуда, кратковременным ухудшением самочувствия. Хотя также возможны
Однако современные технологии и высокая квалификация врачей позволяют максимально снизить риски. Серьезные осложнения после ТАХЭ в настоящее время возникает только у 5% пациентов.
Последние новости
Последние статьи
Рейтинг: 4.0/5 Голоса: 1
Фетальная генная терапия: от теории — к практике
Фетальная генная терапия: от теории — к практике
Фетальная терапия плода уже совсем скоро может позволить успешно лечить генетические аномалии, рак и другие заболевания
Автор
Редактор
Статья на конкурс «био/мол/текст»: «Миша родился 12 февраля здоровым ребенком. Но в 1,5 месяца я стала замечать, что на всех фотографиях малыш занимает одну и ту же позу, как будто его ножки неподвижны. Уже через несколько недель нам поставили диагноз, посочувствовали и посоветовали начать планировать второго, здорового ребенка». Из-за роковой комбинации генов Миша, как и остальные дети с этим заболеванием, был вынужден всю свою короткую жизнь бороться за каждое движение. Бороться отчаянно, изо всех сил, но в конце концов проиграть. Спинальная мышечная атрофия (СМА) относится к числу генетических аномалий, перед которыми человечество пока бессильно. Однако успехи генной терапии, за которыми сегодня наблюдает медицинский мир, могут перевести и СМА, и другие тяжелые наследственные патологии в разряд излечимых. Более того — излечимых еще внутриутробно.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Биофармацевтика» конкурса «био/мол/текст»-2018.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Природа ошибается, человек исправляет
«Биомолекула» уже писала подробно о том, какие возможности открывает генная терапия в лечении рака [2] и наследственных аномалий, в частности, пигментного ретинита [3].
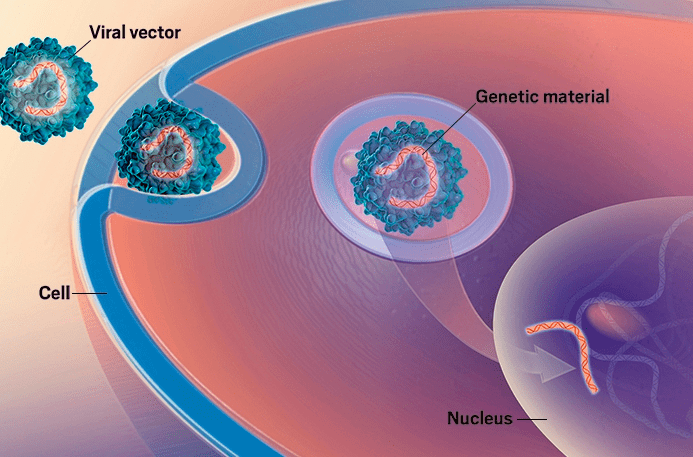
Рисунок 1. Перенос генетического материала в клетку с помощью вирусного вектора
И если в 80-х годах прошлого века, когда о генной терапии заговорили довольно громко, ее теория многим казалась продолжением сценария ленты «Назад в будущее», то сегодня она стала реальностью, открывающей новые, поистине безбрежные перспективы.
Тем не менее очевидно, что генная терапия имеет ряд ограничений, особенно когда речь идет о наследственных заболеваниях. Прежде всего, патологический процесс в таких случаях может начаться еще внутриутробно. К моменту, когда заболевание, наконец, диагностируют, — а это порой происходит спустя годы после рождения ребенка, — могут развиться необратимые повреждения клеток и органов, что значительно сужает терапевтические возможности или вообще сводит их на нет [4].
Шанс решить эту проблему появился благодаря современной пренатальной диагностике, которая позволяет обнаружить хромосомные дефекты уже на ранних стадиях беременности. Получив любой фетальный материал с помощью инвазивных методик, можно быстро и достоверно диагностировать генетические заболевания. А в случаях с гемоглобинопатиями необходимость в инвазивных манипуляциях и вовсе отпадает: чтобы их выявить, достаточно исследовать фетальные ДНК, полученные из клеток крови матери [5].
Современные пренатальные диагностические методики в комбинации с достижениями генной терапии предоставляют уникальную возможность исправить «ошибку» природы и вмешаться в патологический процесс еще до необратимого повреждения клеток. Обеспечить лечение различных заболеваний ребенка в утробе матери или, по крайней мере, сдержать прогрессирование болезни, по всей вероятности, может фетальная генная терапия, или генная терапия плода.
Идея фетальной генной терапии далеко не нова: всего через несколько лет после первой попытки проведения генной терапии у взрослых, в 1994 году исследователи начали всерьез обсуждать применение инновационной методики внутриутробно [6]. Сегодня, когда лечение генетических заболеваний в утробе матери уже практически превратилось из фантастической перспективы в реальность, опубликована масса работ, где подробно изучена фетальная генная терапия и ее преимущества по сравнению с генной терапией взрослых.
Пренатально vs постнатально
Предваряя вопросы о целесообразности внутриутробной коррекции генетической аномалии, сразу же остановимся на преимуществах генной терапии плода по сравнению с постнатальной генной терапией.
Широкие возможности воздействия на органы и системы
Известно, что при многих генетических заболеваниях (к примеру, буллезном эпидермолизе или кистозном фиброзе) бывает довольно сложно повлиять на основные звенья патологического процесса практически сразу после рождения. Коррекция же мутантных генов у развивающегося плода позволяет быстро увеличить популяцию стволовых клеток, обеспечив большой пул трансфицированных клеток и, как следствие, выраженный терапевтический эффект.
Упрощенное производство клинического вектора, переносящего генетический материал
Дозировка вирусного вектора, с помощью которого переносят генетический материал, зависит от массы тела. Благодаря малому размеру плода удается достигнуть гораздо более высокого биораспределения вектора при той же его дозировке, что в ходе генной терапии взрослого. Это позволяет сэкономить и время, и средства. Представить, насколько существенна экономия, помогают простые сравнительные данные: так, плод в 14–16 недель беременности (оптимальный срок индуцирования вектора) весит около 100 г, в то время как средняя масса тела взрослого составляет около 60 кг.
Повышение эффективности терапии за счет неполноценного иммунного ответа
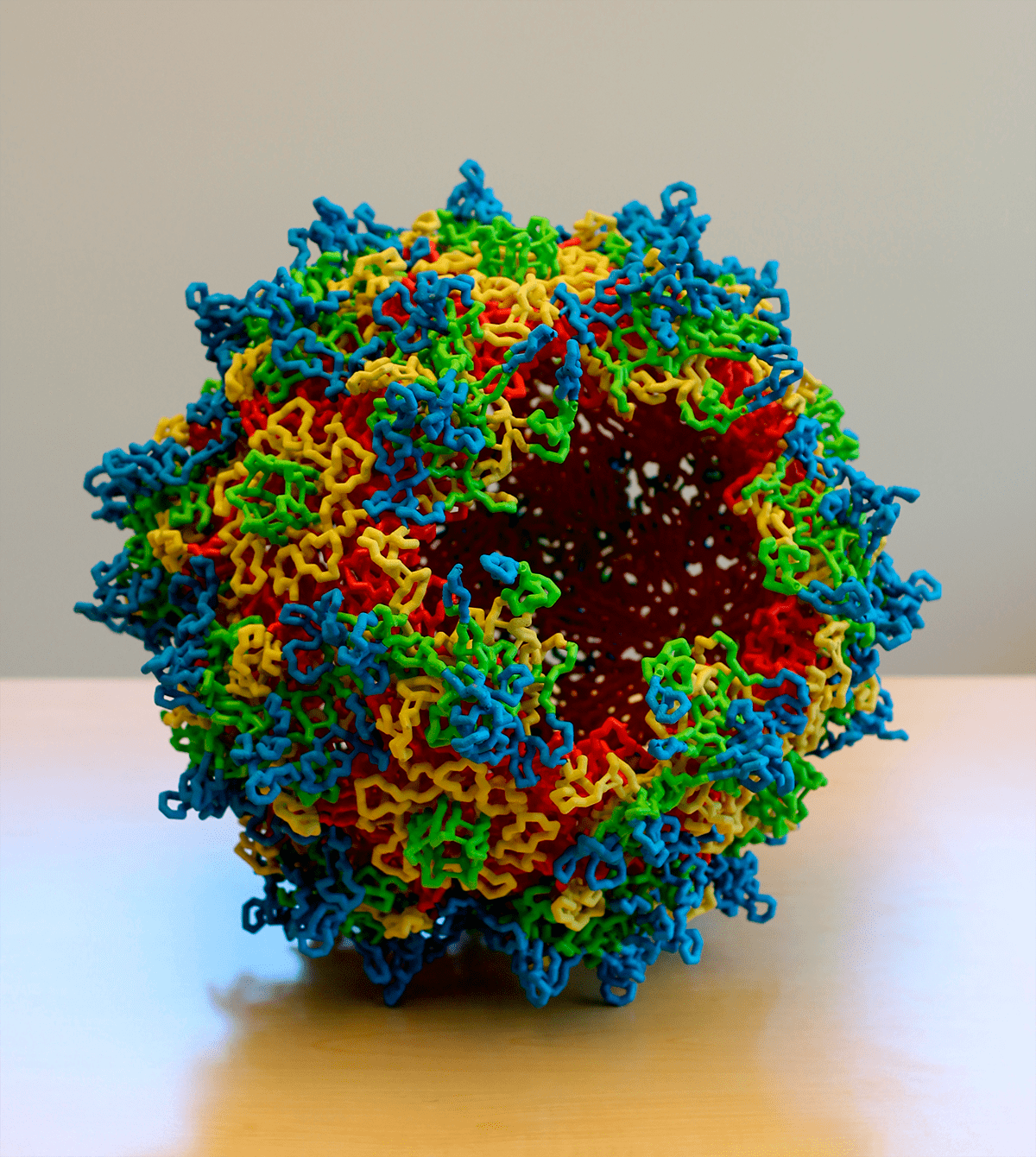
Рисунок 2. Трехмерная модель капсида аденоассоциированного вируса, содержащего 60 белковых субъединиц
Ряд исследований продемонстрировал, что гуморальный иммунитет к аденовирусам и аденоассоциированным вирусам (AAV) (рис. 2) определенных серотипов, которые обычно используются в качестве векторов, может приводить к неудаче при экспрессии трансгена [7]. Это может стать одним из критических барьеров для успешной трансплантации.
В группу риска попадают около 50% взрослых, имеющих приобретенный иммунный ответ к этим вирусным векторам [8]. Но даже при отсутствии чувствительности введение вектора у взрослых нередко приводит к развитию иммунного ответа, снижающего длительность и уровень трансгенной экспрессии. Так, после внутримышечной инъекции аденовирусного вектора с геном белка дистрофина взрослым мышам с миодистрофией Дюшенна образуются антитела к дистрофину [9], что сопряжено со значительным снижением эффективности экспрессии. В то же время плод в утробе матери иммунологически незрел, что позволяет доставлять вирусный вектор и трансгенный продукт без ограничения, которое накладывает иммунный ответ [10].
Очевидные преимущества фетальной терапии по сравнению с постнатальной коррекцией обеспечивают ее более высокую эффективность и целесообразность, особенно при тяжелых, опасных для жизни заболеваниях. Даже в случаях, когда полного излечения достигнуть невозможно, фетальная генная терапия может влиять на патологические звенья заболевания, облегчая его течение и улучшая прогноз. А, следовательно, именно она может стать единственной терапевтической альтернативой прекращению беременности для тысяч семей. Тем более что число заболеваний, которые потенциально могут оказаться под контролем при внедрении генной терапии плода в клиническую практику, поистине огромно.
Перспективы и возможности
Генная терапия плода, предположительно, способна взять под контроль множество опасных патологий. Лишь малая их толика представлена в таблице 1.
| Заболевание | Геннотерапевтический препарат | Целевые клетки и/или орган | Возраст манифестации заболевания | Распространенность | Продолжительность жизни |
|---|---|---|---|---|---|
| Кистозный фиброз | CFTR (трансмембранный регулятор) | Эпителиальные клетки дыхательных путей и кишечника | Третий триместр беременности | 1:4000 | Около 35 лет |
| Мышечная дистрофия Дюшенна | Дистрофин | Миоциты | 2 года | 1:4500 | 25 лет |
| Спинальная мышечная атрофия | Белок SMN | Мотонейроны | 6 месяцев (тип I) | 1:10 000 | 2 года |
| Гемофилия [12] | Фактор свертывания крови VIII или IX | Гепатоциты | 1 год | 1:6000 | При корректной терапии нормальная продолжительность жизни |
| Бета-талассемия | Глобин | Прекурсоры эритроцитов | До года | 1:2700 | До 20 лет |
| Болезнь Гоше | Глюкоцереброзидаза | Гепатоциты | 9,5 лет | 1:59 000 | Менее 2 лет |
| Дефекты цикла мочевины | Орнитина транскарбамилаза | Гепатоциты | 2 дня | 1:30 000 | 2 дня |
| Буллезный эпидермолиз | Коллаген тип VII | Кератиноциты | Рождение | 1:40 000 | При корректной терапии нормальная продолжительность жизни |
| Гипоксическая ишемическая энцефалопатия | Нейротрофические факторы | Кортикальные нейроны | Рождение | 1:1000 | При корректной терапии нормальная продолжительность жизни |
| Тяжелая внутриматочная задержка роста | Плацентарные факторы роста | Трофобласт | Плод | 1:500 | Несколько дней |
Кроме того, к числу патологий, которые, предположительно, могут поддаваться контролю с помощью фетальной терапии, относятся [5]:
Список заболеваний, которые могут оказаться «по плечу» фетальной генной терапии, поражает воображение: предположительно, эта методика позволит вмешаться в ранее неподвластные человеку патологические процессы, обусловленные моногенными заболеваниями. Их количество, по данным Всемирной организации здравоохранения, достигает десяти тысяч [10]. Тем не менее важно учитывать существование ряда ограничений, и в первую очередь рисков для матери и плода, сопряженных с проведением внутриутробной генной терапии.
Страхи и риски
Специфические риски пренатального переноса генов кардинально отличаются от рисков постнатальной генной терапии. Они включают краткосрочные неблагоприятные реакции и долгосрочные постнатальные эффекты. Их актуальность обостряется в связи с тем, что гипотетически экспрессия генов плода может оказывать непредсказуемое действие как на пренатальное, так и на постнатальное развитие [13].
Прежде всего, непосредственно сама процедура переноса связана с увеличением вероятности выкидыша, хориоамнионита и преждевременных родов. В исследованиях зафиксированы воспалительные реакции на вектор, в частности, инфильтрация печени и некроз печени при фетальной генной терапии овец [4].
Успех фетальной генной терапии может быть нейтрализован иммунным ответом плода, и это несет определенные риски для конечного результата. Гуморальный и клеточный ответы на введение вектора или трансгенного белка при посредстве трансдукторных систем клеток может элиминировать продукты переноса или нивелировать трансгенную экспрессию. При этом в исследованиях продемонстрирована зависимость силы иммунного ответа от срока гестации. Значительные иммунные реакции на введение лентивирусного вектора на ранних и средних сроках беременности зарегистрированы не были, тогда как при введении аденовирусного вектора на поздних сроках наблюдался мощный гуморальный ответ против капсидного антигена [4].
Одна из чрезвычайно важных проблем фетальной генной терапии заключается в потенциальном риске, который возникает при передаче плоду донорских последовательностей ДНК. Поскольку векторная интеграция в зародышевые клетки, по всей вероятности, будет носить случайный характер, она теоретически может иметь катастрофические последствия для плода. По сути, ребенок, получивший внутриутробно донорский генетический материал, рождается мутантом. Этическая составляющая генной терапии тревожит умы ученых и богословов. Последние еще со времен рождения самой известной в истории науки овечки предупреждают об опасностях, которые несет человечеству вмешательство в замысел божий.
Еще один важный аспект обусловлен вероятностью мутагенеза в клетках плода, приводящего к дефекту какого-либо функционального гена, что в конечном счете может стать причиной теперь уже нового, приобретенного генетического заболевания или злокачественной опухоли. Ее вероятность выглядит еще более реальной с учетом данных исследования на мышах, в ходе которого экспрессия генов у зародышей мышей дала толчок развитию опухоли печени [14].
В этом контексте могут оказаться далеко не случайными результаты двух исследований, продемонстрировавших развитие серьезных побочных эффектов после успешной генной терапии Х-сцепленного комбинированного иммунодефицита: в первом случае была зафиксирована манифестация моноклонального лимфопролиферативного заболевания, а во втором — альфа/бета Т-клеточной пролиферации. И в первом, и во втором случаях ретровирусный вектор интегрировался в непосредственной близости от гена LMO2 в пролиферирующих Т-клетках [15].
Теоретически генная терапия ex vivo может быть более безопасной по сравнению с in vivo фетальным введением вектора. Хотя это и не исключает вероятность мутагенеза в клетках, которые ретровирально трансдуцируются in vitro, введение мутагена можно легче определять и контролировать. Тем не менее полностью исключить эти осложнения, увы, нельзя.
И, наконец, фетальная генная терапия повышает восприимчивость клеток зародыша к трансдукции. Низкоуровневая ретровирусная трансдукция в предшественники зародышевых клеток наблюдалась в мужских и женских гонадах после внутрибрюшинного введения вектора эмбрионам овец и обезьян соответственно [13]. Анализ факторов, приводящих к непреднамеренной трансдукции, показал, что восприимчивость зародышевой ткани к ней зависит от гестационного возраста с более высокими показателями трансдукции на ранней стадии беременности [10].
С точки зрения потенциальных рисков очевидно, что фетальная генная терапия может быть обоснованным методом лечения только тяжелых генетических заболеваний, других вариантов коррекции которых не существует. И среди них, безусловно, болезнь Гоше, возможность внутриутробной генной терапии которой продемонстрировали в исследовании, опубликованном совсем недавно.
Первый пошел: болезнь Гоше
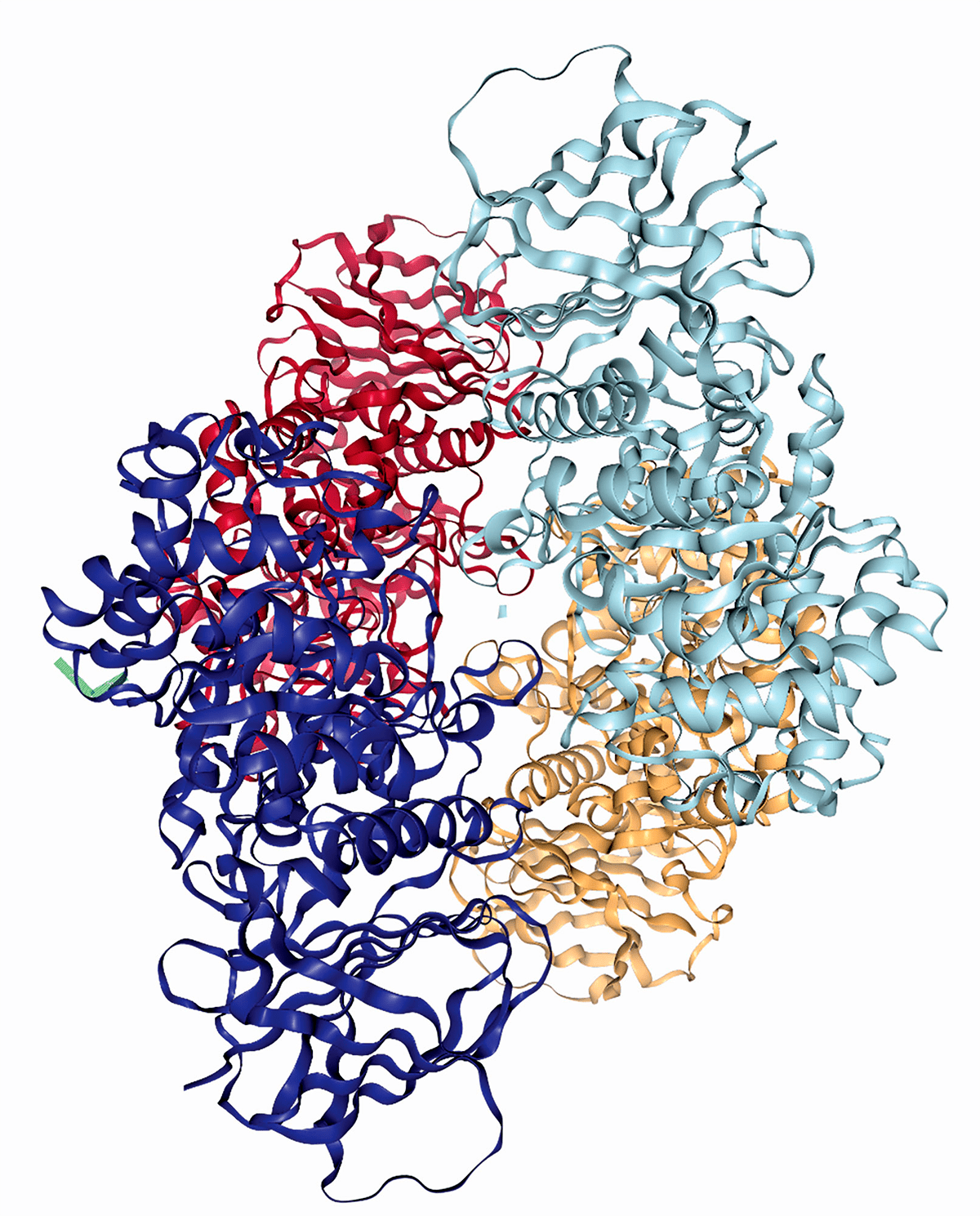
Рисунок 3. Структура димера глюкозоцереброзидазы — фермента, уровень которого патологически снижается при болезни Гоше
В июле 2018 года журнал Nature Medicine опубликовал результаты исследования на мышах, проведенного под руководством Симона Уоддингтона (Simon Waddington) из лондонского Института женского здоровья. Результаты работы продемонстрировали эффективность фетальной генной терапии в лечении нейродегенеративных заболеваний и, в частности, болезни Гоше [16]. Это самая частая форма среди редких наследственных ферментопатий, в основе которой лежит дефицит активности лизосомного фермента глюкозоцереброзидазы (рис. 3), обусловленный мутациями в гене глюкозилцерамидазы. В зависимости от характера мутаций, может развиваться тяжелая нейропатическая форма заболевания, манифестирующая с младенчества, или форма с более постепенным началом и менее выраженными симптомами. В то время как более легкие формы болезни Гоше хорошо поддаются заместительной терапии, тяжелая форма пока остается летальной. Признаки неизлечимой формы болезни Гоше появляются в первые месяцы жизни и включают прогрессирующую мышечную гипотонию, задержку и регресс психомоторного развития и другие неврологические признаки.
В ходе исследования Уоддингтон с соавторами продемонстрировал, что интракраниальное введение аденоассоциированного вирусного вектора 9 (AAV9) эмбриону мышей на 16 день гестации приводило к повышению экспрессии глюкозоцереброзидазы, что останавливало нейродегенерацию. При этом активность фермента в головном мозге была сравнима с таковой у здоровых мышей. Несмотря на то, что у больных грызунов все же диагностировался воспалительный процесс в головном мозге, они развивались достоверно лучше, чем мыши из группы контроля, которых пришлось усыпить через две недели после лечения из-за тяжести заболевания.
Мыши, подвергшиеся фетальной генной терапии, жили, по крайней мере, 18 недель, были фертильными и мобильными. Интересно, что введение вектора постнатально также облегчало течение заболевания, однако было менее эффективным, чем пренатальная экспрессия.
Поскольку AAV9 был способен проникать в мозг из кровотока, команда Уоддингтона провела еще один эксперимент, в ходе которого ввели значительно более высокую дозу вектора не в головной мозг, а непосредственно в кровь зародышей мышей. Мыши после экспрессии были в основном неотличимы от здоровых особей, но, поскольку по условиям эксперимента продолжительность их жизни составила только 55 дней, ученые не смогли сделать выводы о долгосрочной эффективности внутривенной генной терапии.
Эксперимент Уоддингтона стал самой сложной на сегодня работой, в ходе которой была проведена фетальная генная терапия у животных. Сегодня команда работает с корпорацией Apollo Therapeutics, объединившей усилия трех британских университетов и трех крупнейших фармацевтических компаний. Уоддингтон с коллегами преследуют новую цель: на сей раз перед ними стоит задача получить доклинические данные и потенциально протестировать лечение людей. И пока скептики размышляют над кругом возможностей применения фетальной генной терапии у человека, который может значительно сужаться из-за того, что болезнь Гоше не входит в пренатальные тесты, команда Уоддингтона уверенной поступью шагает в будущее. Будущее, где смогут выздоравливать дети с болезнью Гоше, миодистрофией Дюшенна, СМА и многими другими редкими, но сегодня, увы, неизлечимыми заболеваниями.