ферротерапия это такое что
Что такое железодефицитная анемия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Головко О. А., терапевта со стажем в 12 лет.
Определение болезни. Причины заболевания
Основные причины развития ЖДА:
Группы риска по ЖДА:
Симптомы железодефицитной анемии
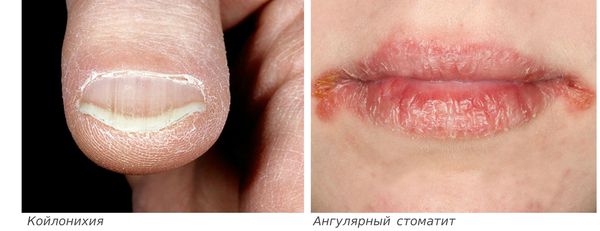
Сидеропенический синдром связан с недостатком железа в тканях и проявляется нарушениями со стороны кожи и слизистых оболочек:
Анемический синдром проявляется слабостью, быстрой утомляемостью, сонливостью днём и плохим засыпанием ночью, головокружениями, обмороками, частыми головными болями, шумом в ушах, мельканием «мушек» перед глазами, одышкой при физической нагрузке, увеличением частоты сердечных сокращений, неприятными ощущениями в области сердца, пониженным артериальным давлением.
При ЖДА может наблюдаться умеренное повышение температуры тела (до 37,5 ° С), которое исчезает после лечения железосодержащими препаратами.
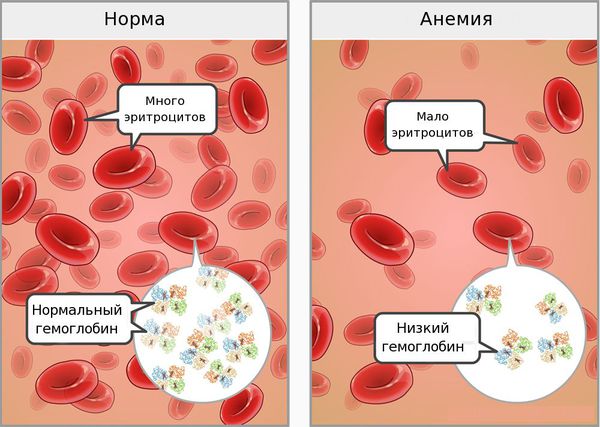
Зачастую снижение содержания гемоглобина происходит постепенно, при этом многие органы адаптируются к анемии. В связи с этим жалобы больных не всегда соответствуют показателям содержания гемоглобина. Многие пациенты, особенно женщины, свыкаются с неважным самочувствием, приписывая его переутомлению, психическим и физическим перегрузкам.
Патогенез железодефицитной анемии
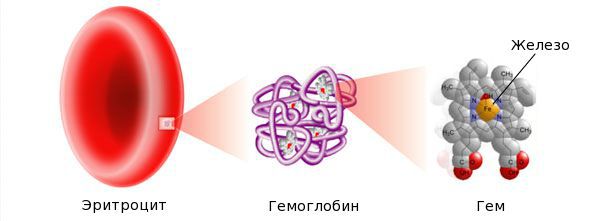
Железо — жизненно важный для человека микроэлемент, который входит в состав гемоглобина крови, миоглобина мышц, отвечает за транспорт кислорода в организме и протекание многих биохимических реакций.
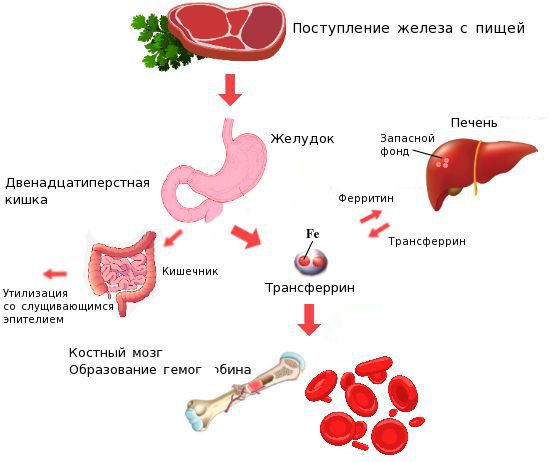
Железо поступает в организм в виде двухвалентного (мясная пища) и трёхвалентного (растительная пища) ионов. Первый всасывается легко, второй под действием соляной кислоты в желудке должен превратиться в двухвалентный. Далее он поступает в двенадцатиперстную кишку и начальные отделы тощей кишки, затем двухвалентное железо вновь переводится в трёхвалентное. В дальнейшем часть этого железа поступает в депо слизистой оболочки тонкой кишки, а другая всасывается в кровь, где соединяется с трансферрином (белком-переносчиком железа, синтезируемым в печени). Если содержание железа в организме избыточно, то оно задерживается в клетках кишечника и в дальнейшем удаляется из организма вместе со слущивающимся эпителием.
При снижении кислотности в желудке (атрофический гастрит, резекция желудка, приём препаратов, снижающих кислотность, гиповитаминоз С) нарушается ионизация железа в желудке, что ведёт к дальнейшему нарушению всасывания железа и развитию ЖДА. При резекции и хронических заболеваниях кишечника (дуоденит, хронический энтерит, целиакия) нарушается всасывание железа, что опять же приводит к развитию ЖДА.
Ферменты, содержащие железо, принимают участие в синтезе гормонов щитовидной железы и поддержании иммунитета, поэтому при дефиците железа нарушаются защитные и адаптационные силы организма и весь обмен веществ.
Классификация и стадии развития железодефицитной анемии
Выделяют три стадии железодефицитных состояний: прелатентный дефицит железа, латентный дефицит и железодефицитную анемию (ЖДА).
Для прелатентного дефицита железа характерно снижение запасов железа в костном мозге:
На этой стадии симптомов может не быть.
Латентный (скрытый) дефицит железа влияет на тканевой обмен. На этой стадии запасы железа начинают истощаться, но организм ещё не успел отреагировать снижением гемоглобина. Возникают первые проявления заболевания — человека может беспокоить повышенная утомляемость, слабость, одышка при физической нагрузке, ломкость ногтей, сухость кожи, выпадение волос. Но эти симптомы пока выражены незначительно.
Латентный дефицит железа характеризуется:
На третьей стадии (собственно ЖДА) снижается уровень гемоглобина и эритроцитов.
Для железодефицитной анемии характерно:
Для этой стадии характерна ярко выраженная клиническая симптоматика, хотя зачастую люди списывают эти проявления на переутомление.
В норме уровень гемоглобина в крови: у женщин — 120-140 г/л, у мужчин — 130-160 г/л.
Степени тяжести ЖДА (на основании снижения уровня гемоглобина Hb):
Осложнения железодефицитной анемии
У беременных с ЖДА повышается риск преждевременных родов и задержки роста плода. У детей недостаток железа приводит к задержке роста и интеллектуального развития.
Диагностика железодефицитной анемии
Минимальный объём исследований:
Биохимический анализ крови покажет снижение уровня сывороточного железа и ферритина, увеличение общей железосвязывающей способности сыворотки и растворимых трансферриновых рецепторов, снижение коэффициента насыщения трансферрина железом (НТЖ).
Лечение железодефицитной анемии
Лечение проводится железосодержащими препаратами, в основном для приёма внутрь и значительно реже для внутримышечного или внутривенного введения. Препараты нельзя принимать без назначения врача, так как переизбыток железа опасен своими последствиями — поражением зубов, развитием гепатита, цирроза печени, сахарного диабета и сердечно-сосудистых заболеваний. Также возможны тяжёлые аллергические реакции.
При анемии следует изменить рацион питания и включить в него продукты, содержащие железо в наиболее усвояемой форме — телятину, говядину, баранину, мясо кролика, печень, язык. Важно помнить, что из мяса усваивается до 30 % железа, из рыбы — 10 %, а из растительной пищи — всего лишь 3-5 %.
При анемии коррекция дефицита железа не может быть достигнута только изменением питания. Причина этого в том, что усвоение железа из пищи ограничено, а в препаратах оно содержится в большей концентрации.
При анемии лёгкой и средней степени тяжести препараты железа лучше принимать внутрь вместе с аскорбиновой или фолиевой кислотой, так как они улучшают всасываемость железа.
Если препараты железа невозможно применять внутрь (например, при непереносимости или нарушении всасывания железа в кишечнике), то их вводят внутримышечно или внутривенно. Инъекционные препараты железа используют только в стационаре, так как они могут вызывать шоковые реакции. Их нельзя применять во время беременности и лактации.
При тяжёлой анемии (гемоглобин менее 70 г/л) и по жизненным показаниям в условиях стационара проводят переливание эритроцитарной массы.
В качестве лечебно-профилактического средства пациентам, у которых нет сахарного диабета, можно использовать гематоген. В его состав входят железо, связывающее белки, получаемые из крови крупного рогатого скота, а также аскорбиновая кислота и необходимый комплекс белков. Однако это достаточно калорийный продукт — в 100 г гематогена содержится 350–500 килокалорий, об этом следует помнить, включая его в рацион.
Прогноз. Профилактика
Прогноз при ЖДА благоприятный. В большинстве случаев заболевание успешно лечится амбулаторно. Но если не анемию не лечить, то она может прогрессировать, ухудшая общее самочувствие. ЖДА сложно скорректировать в следующих случаях:
Для профилактики ЖДА следует:
Лечение железодефицитной анемии и дефицита железа
Лечение железодефицитной анемии и дефицита железа
О современных представлениях коррекции дефицита железа и основных характеристиках железосодержащих препаратов, принципах их выбора и дозирования при железодефицитных состояниях.
Диета при железодефиците и источники железа в пище
Основным источником железа для человека являются продукты животного происхождения. В природе железо существует в двух химических формах: 2-валентное (гемовое) и 3-валентное (негемовое). Гемовое железо хорошо всасывается в кишечнике. Наиболее богаты гемовым железом мясо, особенно говядина, кровяная колбаса. В птице и рыбе гемового железа гораздо меньше. Печень (свиная и телячья), почки, сердце, ливерная колбаса богаты ферритином и гемосидерином, содержащими негемовое железо (последнее плохо всасывается в желудочно-кишечном тракте). Много негемового железа содержится в некоторых марках красного вина, фруктовых соках, яблоках, гранатах, гречневой крупе, молочных продуктах, яйцах, орехах и шоколаде. Биодоступность такого железа минимальна, и все эти продукты не являются источником железа. Вегетарианство является мощным фактором риска железодефицитной анемии (ЖДА) в любом возрасте. При этом в рацион должны входить зелень, овощи, фрукты, т. к. усвоение железа улучшается при наличии в пище витамина С. Всасывание железа ухудшают танин (содержащийся в чае и кофе), фитин (содержащийся в рисе, соевой муке), молоко и творог из-за высокого содержания кальция. Поскольку усвоение железа из пищи ограничено, медикаментозная терапия анемии является основной.
Всемирной организацией здравоохранения (ВОЗ) в 1993 – 2005 годах проведено глобальное исследование, показавшее, что 24,4% всех жителей земного шара страдает разными формами анемии. Чаще всего анемия встречается у детей дошкольного возраста (47% от общей популяции), беременных женщин (41,8%) и небеременных женщин детородного возраста (30,2%). В структуре анемий: 37% занимает железодефицитная анемия, 27% – анемия при хронических заболеваниях (АХЗ).
Среди женщин фертильного возраста лидирующие позиции занимает железодефицитная анемия (ЖДА). Анемический синдром является самым частым гематологическим синдромом, встречающимся в клинической практике. Анемия – это не диагноз, а только синдром, требующий особого алгоритма дифференциальной диагностики.
Исследование ВОЗ свидетельствуют о том, что ЖДА является третьей по распространенности причиной временной потери трудоспособности у женщин в возрасте 15–44 лет. Наряду с собственно ЖДА существует скрытый дефицит железа, который в Европе и России составляет 30–40%, в отдельных регионах – 50–60%. По данным ВОЗ, дефицит железа определяется у 20–25% всех младенцев, 43% – у детей в возрасте до 4 лет и до 50% – у подростков (девочки). Таким образом, наиболее частыми анемиями как в Беларуси, так и в других странах, являются ЖДА и АХЗ. Анемия является ведущим фактором ухудшения самочувствия пациента, по приблизительным оценкам ею страдают 2,4 млрд населения земного шара.
Основными причинами развития железодефицитной анемии являются: кровопотери (обильные менструальные кровотечения, беременность, роды, желудочно-кишечные, легочные, при заболевании почек); нарушения всасывания железа (резекция желудка и кишечника, недостаточность поджелудочной железы, глютеновая энтеропатия, болезнь Крона); повышенная потребность в железе (быстрый рост, недоношенные, новорожденные дети, подростки, беременность и лактация); недостаточное поступление с пищей (вегетарианская или веганская диета).
Необходимо помнить, что ЖДА – финал выраженного железодефицита, при котором снижается эритропоэз (кроветворение) и, как следствие, уменьшается содержание гемоглобина.
Предлатентный дефицит железа характеризуется снижением запасов микроэлемента без уменьшения расходования железа на эритропоэз. Латентный дефицит железа наблюдается при полном истощении запасов микроэлемента в депо, однако признаков развития анемии нет. Манифестный дефицит железа, или железодефицитная анемия (ЖДА), возникает при снижении гемоглобинового фонда железа и имеет характерные симптомы. Снижение концентрации сывороточного ферритина ниже 12 мкг/л у здоровых детей и 15 мкг/л у взрослых, с поправкой ниже 30 мкг/л у детей и 70 мкг/л у взрослых с инфекционными или воспалительными заболеваниями, означает неизбежное снижение концентрации гемоглобина в последующем.
Основой патогенетической терапии ЖДА является применение препаратов железа внутрь. Лечение препаратами железа должно быть длительным и зависит от исходной тяжести анемии (уровня гемоглобина и дефицита железа).
На амбулаторном этапе лечение осуществляется при уровне гемоглобина >80 г/л и удовлетворительном общем состоянии пациента. Пероральное назначение железосодержащих ЛС в дозе 200-300 мг/сутки в течение 4-6 недель до нормализации уровня гемоглобина, после чего продолжается прием ЛС в дозе 100 мг/сутки в течение 2-3 месяцев до содержания ферритина не менее 40 мкг/л. Необходим поиск причины дефицита железа и устранение причины дефицита железа – это лечение основного заболевания, вызвавшего дефицит железа.
Принципы выбора препарата железа для терапии
В настоящее время пероральные препараты железа разделены на две основные группы: ионные и неионные (последние представлены протеиновым и гидроксиполимальтозным комплексом 3-валентного железа).
Ионные препараты представлены солями 2-валентного железа, в т. ч. сульфатом железа (феррофол, тардиферон, ферроплекс, сорбифер, ферро-фольгамма и др.); хлоридом железа (гемофер); полисахаридными соединениями – глюконат-фумаратными комбинациями (хеферол, ферронал, мегаферрин). Хелаты 2-валентного железа (цитрат, лактат, глюконат, сукцинат) всасываются лучше, чем сульфат железа. В случае непереносимости солевых препаратов 2-валентного железа, являющихся на сегодняшний день наиболее эффективными в лечении анемии и восполнении депо железа, возможно использование неионных препаратов 3-валентного железа в виде гидроксиполимальтозного комплекса (мальтофер, биофер, феррум лек и др.).
При выборе лекарственного препарата и оптимального режима дозирования необходимо помнить, что адекватный прирост показателей гемоглобина при ЖДА может быть обеспечен поступлением в организм от 30 до 100 мг 2-валентного железа. Учитывая, что при развитии ЖДА всасывание железа увеличивается на 25–30% (при нормальных запасах железа в организме – всего 3–7%), назначают от 100 до 300 мг 2-валентного железа в сутки. Применение более высоких доз не имеет смысла, поскольку всасывание железа при этом не увеличивается. Степень абсорбции 2-валентных солей железа в несколько раз выше, чем 3-валентного, поэтому препараты, содержащие 2-валентное железо, дают быстрый эффект и нормализуют уровень гемоглобина в среднем через 1–2 месяцев, а нормализация уровня железа в депо происходит через 3–4 месяца от начала лечения и зависит от степени тяжести анемии и дозы препарата. Требуется более длительное применение препаратов, содержащих железо в 3-валентном состоянии, в случае дефицита меди в организме они будут неэффективны. Нормализация уровня гемоглобина при лечении препаратом 3-валентного железа наступит только через 2–4 месяца, а восполнение дефицита железа в депо – через 5–7 месяцев от начала терапии. Степень абсорбции отражается и на частоте развития побочных эффектов. Уменьшить нежелательное влияние твердых форм препаратов железа (таблетированных, капсулированных) на слизистую оболочку ЖКТ можно, принимая их во время еды, но при этом уменьшается всасывание железа.
При приеме препаратов в достаточной дозе на 7–10-й день от начала лечения наблюдается повышение количества ретикулоцитов. Нормализация уровня гемоглобина отмечается через 3–4 недели от начала лечения, а в ряде случаев затягивается до 6–8 недель. Общая длительность лечения зависит от исходной тяжести анемии. Стандартные сроки проведения ферротерапии ЖДА: при легкой степени тяжести – 4-6 недель, при средней степени – 8–12 недель, при тяжелой – 16 недель и более. На фоне применения ферропрепаратов внутрь наиболее часто возникают тошнота, рвота, анорексия, запоры (т. к. железо связывает сероводород, являющийся физиологическим стимулятором моторики), реже – поносы, металлический привкус во рту, окрашивание слизистых оболочек и зубов в черный цвет, аллергические реакции, головная боль. Эти побочные эффекты приводят к частым отказам пациентов от лечения.
Биодоступность двухвалентных солей железа в несколько раз выше, чем трехвалентных, так как они свободно диффундируют через каналы ДМТ1-белков и ферропортин. Фармакологический эффект препаратов быстрый, и нормализация уровня гемоглобина в среднем происходит через 2 недели ‒ 2 месяца, а восполнение депо железа происходит уже через 3‒4 месяца от начала лечения, в зависимости от тяжести анемии и дозировки препарата. В связи с чем ВОЗ рекомендует препараты двухвалентного железа в качестве стартовой терапии железодефицитной анемии. Всасывание ионов из препаратов трехвалентного железа более медленное, так как необходима активная (энергозависимая) трансформация с участием феррооксидаз. Поэтому такие препараты требуют более длительного применения, а в случае дефицита меди в организме будут неэффективны вообще.
Лекарственный препарат Феррофол производства УП «Минскинтеркапс» содержит в одной капсуле 50 мг сульфата железа (II) и 500 мкг фолиевой кислоты. Применяя Феррофол в среднесуточной дозировке по 1 капсуле 2-3 раза в день за 1 час до еды (100-150 мг в сутки), достигается цель лечения железодефицитной анемии – введение железа в количестве, необходимом для нормализации уровня гемоглобина, соответствует рекомендации ВОЗ об оптимальной лечебной дозе.
Лекарственный препарат Феррофол отвечает основным требованиям к проведению лечения препаратами железа:
Преимущества препарата Феррофол:
выпускается в форме капсул пролонгированного действия, активные ингредиенты содержатся в пеллетах (микрогранулах), которые обеспечивают их всасывание в верхнем отделе тонкой кишки, в связи с чем отсутствует местное раздражающее действие на слизистую оболочку желудка, что обеспечивает хорошую желудочно-кишечную переносимость. Использование пеллет в капсулах Феррофол позволяет изолировать друг от друга активные вещества – фолиевую кислоту и железо в одной готовой форме. Фолиевая кислота повышает синтез ДНК в кроветворных клетках, что положительно влияет на скорость синтеза гемоглобина, а значит, более быстрое купирование анемии.
Лекарственный препарат Феррофол показан для профилактики и латентного дефицита железа и железодефицитной анемии, особенно во время беременности.
Профилактика железодефицитной анемии и латентного дефицита железа показана пациентам группы риска, к которым относятся:
Феррофол – комбинированный лекарственный препарат, восполняющий дефицит железа и фолиевой кислоты в организме.
Капсулы нужно глотать целиком, запивая стаканом воды. Капсулу нельзя рассасывать, разжевывать и держать во рту.
Прием осуществляют до или во время приема пищи, в зависимости от желудочно-кишечной переносимости.
Имеются медицинские противопоказания и нежелательные реакции.
ПЕРЕД ПРИМЕНЕНИЕМ ЛЕКАРСТВЕННОГО ПРЕПАРАТА ОЗНАКОМЬТЕСЬ С ИНСТРУКЦИЕЙ
Выбор препаратов железа для ферротерапии железодефицитной анемии у детей
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Российская медицинская академия последипломного образования МЗ РФ
Ж елезодефицитная анемия (ЖДА) составляет более 80% всех анемий у детей [2,1]. Наиболее предрасположены к развитию ЖДА дети раннего возраста и подростки. В настоящее время показано, что длительный дефицит железа у детей раннего возраста может способствовать нарушению миелинизации нервных волокон, формирования структур мозга, что сопровождается задержкой умственного и моторного развития. Нередко симптомы сидеропении в раннем возрасте, особенно во втором полугодии жизни, мало заметны [9]. У подростков симптомы железодефицитного состояния (ЖДС) могут иметь своеобразный характер – наблюдается повышенная утомляемость, мышечная слабость, снижение памяти, снижение эмоционального тонуса и др. Этот астенический синдром часто связывают с переутомлением, особенностями подросткового периода и другими причинами, что может приводить к поздней диагностике ЖДС [5,4]. ЖДА и латентный дефицит железа (ЛДЖ) заметно ухудшают качество жизни больных, приводят к снижению успеваемости, невротическим реакциям, конфликтам в школе и дома. Причины развития сидеропенических состояний у детей очень разнообразны и во многом определяются особенностями обмена железа в определенные возрастные периоды.
Нередко при своевременной диагностике ЖДА у детей проводится нерациональная ее терапия (например, применение только диетотерапии, парентеральное введение препаратов железа, лечение «большими» дозами препаратов железа и др.) [1,7]. Остаются предметом дискуссии вопросы длительности ферротерапии при различных стадиях ЖДС (ЖДА, ЛДЖ). Все это диктует необходимость уточнения оптимальных доз и сроков терапии препаратами железа разных групп при различных стадиях ЖДС.
Сегодня на фармацевтическом рынке страны имеется большой выбор препаратов железа, представленных монокомпонентными и комбинированными соединениями солей железа и препаратов на основе гидроксид–полимальтозного комплекса. Перед врачом – педиатром встает непростая задача дифференцированного подбора препарата железа для ребенка с учетом не только эффективности, но и их переносимости.
Терапия железодефицитных состояний должна быть направлена на устранение причины и одновременное восполнение дефицита железа железосодержащими препаратами. Принципы лечения ЖДА сформулированы Л.И. Идельсоном в 1981 году [6] и не потеряли своей актуальности до настоящего времени.
Главные постулаты Л.И. Идельсона о лечении ЖДА:
Выбору препарата для коррекции сидеропении придается особое значение, поскольку длительность лечения составляет несколько месяцев. При этом важна не только высокая эффективность лечения, но и отсутствие побочных эффектов, а также приверженность к проводимой терапии, особенно в педиатрической практике [8].
В настоящее время все препараты железа можно разделить на две группы: ионные железосодержащие препараты (солевые, полисахаридные соединения железа) и неионные соединения, к которым относятся препараты гидроксид–полимальтозного комплекса трехвалентного железа. Данная классификация основана на различии механизмов всасывания железа из ионных и неионных соединений. Всасывание железа из ионных соединений происходит преимущественно в двухвалентной форме, тогда как активность утилизации железа из препаратов, содержащих соли трехвалентного железа, жестко лимитируется определенным уровнем рН желудочного сока (при высокой кислотности желудочного сока образуются труднорастворимые гидроксиды железа). Вследствие этого наиболее часто используются двухвалентные солевые препараты железа, обладающие хорошей растворимостью, высокой способностью к диссоциации. Попадая в желудочно–кишечный тракт, соединения двухвалентного железа проникают в мукозные клетки слизистой кишечника (проходят «слизистый барьер»), а затем в кровяное русло посредством механизма пассивной диффузии. В кровяном русле происходит процесс восстановления двухвалентного железа в трехвалентную форму с участием ферроксидазы–I и соединяются с трансферрином и ферритином, образуя пул депонированного железа, которое при необходимости используется в синтезе гемоглобина, миоглобина, других железосодержащих соединений. Как показали многочисленные исследования, частота побочных эффектов зависит от дозы элементарного железа. Чаще всего нежелательные симптомы наблюдаются со стороны желудочно–кишечного тракта (ЖКТ) в виде диареи или запора. Симптомы дисфункции верхних отделов ЖКТ обычно проявляются в течение часа после приема лекарства и могут протекать как в легкой (тошнота, дискомфорт в эпигастрии), так и в тяжелой форме – с болью в животе или рвотой. Кроме того, терапия солевыми препаратами железа сопровождается неопасными, но достаточно неприятными побочными эффектами, такими как появление металлического привкуса во рту в течение первых дней лечения, потемнения зубной эмали и десен. Известно, что у детей, получающих сульфат железа, нередко появляются темные пятна на зубах (до 30% случаев). В то же время, по данным М.К. Соболевой [9], частота побочных проявлений при использовании капель актиферрина у детей раннего возраста, составила всего около 4%. Только у 3% пациентов начало ферротерапии сопровождалось усилением срыгиваний, беспокойством, разжижением и учащением стула, а у 1% больных отмечалось окрашивание эмали зубов.
Хорошо известно, что солевые препараты железа в просвете кишечника взаимодействуют с компонентами пищи, лекарствами, что затрудняет абсорбцию железа. В связи с этим солевые препараты железа рекомендуют назначать за 1 час до приема пищи, однако это может усиливать повреждающее действие соединений двухвалентного железа на слизистую кишечника. С учетом высокого риска развития нежелательных эффектов при лечении ЖДА солевыми препаратами железа, сотрудниками нашей кафедры предложена методика «постепенного наращивания» дозы до терапевтической, учитывающей выраженность дефицита железа в организме и индивидуальную переносимость ребенком препарата, что в случае их развития позволяет своевременно выявить начальные проявления. Стартовое лечение ЖДА начинают с дозы, равной 1/2–1/3 от терапевтической (1–1,5 мг/кг/сутки элементарного железа для детей раннего возраста), с последующим постепенным достижением полной дозы в течение 7–14 дней [7].
Важным аспектом ферротерапии, особенно в педиатрической практике, является терапевтическая безопасность используемых препаратов железа. Высокий риск возникновения побочных эффектов, интоксикации железом при терапии солевыми препаратами железа обусловлен механизмом всасывания двухвалентного железа – путем пассивной диффузии. Солевые препараты содержат железо в двухвалентной форме. Для того чтобы быть усвоенным, Fe2+ подвергается окислению, что способствует образованию свободных радикалов.
Таким образом, заместительная терапия ДЖ с помощью солевых препаратов железа является достаточно эффективной, однако высокий риск развития побочных эффектов снижает в ряде случаев приверженность пациента к лечению.
К новым высокоэффективным и безопасным препаратам железа относятся препараты, представляющие собой неионные соединения железа на основе гидроксид–полимальтозного комплекса (ГПК) трехвалентного железа. Структура комплекса состоит из многоядерных центров гидроксида Fe (III), окруженных нековалентно связанными молекулами полимальтозы. Комплекс имеет большой молекулярный вес, что затрудняет его диффузию через мембрану слизистой кишечника. Химическая структура комплекса максимально приближена к структуре естественных соединений железа с ферритином. Абсорбция железа в виде ГПК имеет принципиально иную схему по сравнению с его ионными соединениями и обеспечивается поступлением Fe (III) из кишечника в кровь путем активного всасывания. Из препарата железо переносится через щеточную каемку мембраны на белке–переносчике и высвобождается для связывания с трансферрином и ферритином, в блоке с которыми депонируется и используется организмом по мере необходимости. Физиологические процессы саморегуляции полностью исключают возможность передозировки и отравления. Существуют данные, свидетельствующие о том, что при насыщении организма железом его резорбция прекращается по принципу обратной связи. Основываясь на физико–химических особенностях комплекса, в частности, на том, что активный транспорт железа осуществляется по принципу конкурентного обмена лигандами (их уровень определяет скорость абсорбции железа), доказано отсутствие его токсичности. Неионная структура комплекса обеспечивает его стабильность и перенос железа с помощью транспортного белка, что предотвращает в организме свободную диффузию ионов железа, т. е. прооксидантные реакции.
Данные по безопасности, полученные во время клинических исследований препарата железа на основе гидроксида Fe (III) с полимальтозой, свидетельствуют о более низкой частоте побочных эффектов по сравнению с солевыми препаратами железа. В редких случаях отмечается чувство переполнения желудка, давления в эпигастрии, тошнота, диарея или запор. Так, в многочисленных рандомизированных исследованиях было показано, что лечение препаратами Fe (III)–ГПК переносилось значительно лучше, чем солевыми препаратами железа (сульфат железа, фумарат железа), что подтверждалось меньшей частотой побочных эффектов со стороны желудочно–кишечного тракта.
После выбора железосодержащего препарата и способа его применения необходимо определить ежедневную суточную дозу лекарственного средства и кратность приема. Суточные терапевтические дозы пероральных солевых препаратов железа при лечении ЖДА у детей предложены экспертами ВОЗ (WHO, 1989): для детей до 3 лет – 3 мг/кг/сутки элементарного железа; для детей старше 3 лет – 45–60 мг/сутки элементарного железа; для подростков – до 120 мг/сутки элементарного железа. При использовании препаратов Fe (III)–ГПК суточная доза для детей раннего возраста составляет 3–5 мг/кг массы. Рекомендуемые дозы двухвалентного железа рассчитаны с учетом того, что лишь 10–15% поступающего в организм железа всасывается.
Терапевтический эффект при пероральном приеме препаратов железа появляется постепенно. Вначале отмечается клиническое улучшение, и лишь спустя некоторое время происходит нормализация гемоглобина. Первым положительным клиническим симптомом, появляющимся при лечении препаратами железа, является уменьшение мышечной слабости. Последнее обусловлено тем, что железо входит в состав ферментов, участвующих в сокращении миофибрилл. На 10–12 день от начала лечения повышается содержание ретикулоцитов в периферической крови. Повышение гемоглобина может быть постепенным, либо скачкообразным, чаще всего начало подъема уровня гемоглобина происходит на 3–4 неделе от начала терапии. Ликвидация клинических проявлений заболевания отмечается через 1–2–3 месяца терапии, а преодоление тканевой сидеропении через 3–6 месяцев лечения [1]. Суточная доза элементарного железа после нормализации уровня гемоглобина должна соответствовать 1/2 терапевтической дозе. Некоторые авторы [3] рекомендуют у недоношенных детей для полного восполнения запасов железа в их организме продолжать ферротерапию в поддерживающих дозах до конца 2–го года жизни. Раннее прекращение лечения препаратами железа, как правило, приводит к рецидивам ЖДА [6].
Таким образом, учитывая длительность проведения ферротерапии, выбор препарата для коррекции сидеропении у детей раннего возраста требует особого внимания. Главными требованиями, предъявляемыми к используемым в детской практике препаратам железа для приема внутрь, являются: достаточная биодоступность, высокая безопасность, хорошие органолептические свойства, наличие различных лекарственных форм, удобных для пациентов всех возрастов, комплаентность [7]. Этим критериям в наибольшей степени отвечают препараты железа на основе ГПК – Феррум Лек, Мальтофер.
Нами проведено изучение эффективности и переносимости препарата Феррум Лек при различных стадиях ЖДС у 43 детей в возрасте от 4 месяцев до 5 лет. Подавляющее большинство пациентов (81%) были в возрасте 1–3 лет, средний возраст составил 1 год 8 месяцев. Наблюдение осуществлялось на базе дома ребенка г. Москвы.
Пациенты получали гидроксид – полимальтозный комплекс железа (III) – препарат Феррум Лек в форме сиропа, который применяли по следующей схеме:
Препарат давали 2 раза в день перед едой, запивая соком.
Обследование детей с целью подтверждения диагноза ЖДА и ЛДЖ включало в себя:
Среди 43 обследованных детей с сидеропенией у 24 выявлена ЖДА (56%). Из них анемия легкой степени отмечена у 15 (63%), средней степени – у 8 (33%), тяжелой степени – у 1 (4%) ребенка. Латентный дефицит железа обнаружен у 19 детей (44%).
Все дети с сидеропенией получали терапию препаратом Феррум Лек в дозе 5 мг/кг/сутки при ЖДА и 2,5 мг/кг/сутки – при ЛДЖ.
Длительность основного курса лечения препаратом Феррум Лек (в полной дозе) составила:
Продолжительность профилактического приема Феррум Лек – сиропа в дозе 2,5 мг/кг/сутки (с целью создания депо железа в организме) составила:
Таким образом, общая длительность ферротерапии при ЖДА составила от 12 до 20 недель. Наши наблюдения показали высокую эффективность препарата Феррум Лек при лечении ЖДС у детей. В среднем в течение 8–12 недель у всех детей нормализовался уровень гемоглобина и сывороточного ферритина, что свидетельствует не только о ликвидации ЖДА, но и о восполнении депо железа в организме (табл. 1). Динамика показателей уровней гемоглобина и сывороточного ферритина у ребенка с тяжелой ЖДА представлена на рис. 1.
Рис. 1. Динамика уровней гемоглобина (Hb), сывороточного железа (СЖ), общей железосвязывающей способности (ОЖСС) и ферритина (СФ) у ребенка с ЖДА тяжелой степени на фоне лечения препаратом Феррум Лек.
Продолжительность терапии препаратом Феррум Лек у детей с ЛДЖ составила от 4 до 8 недель.
Критерием определения оптимального срока ферротерапии при ЛДЖ является восстановление уровня сывороточного ферритина. Динамика содержания ферритина в сыворотке крови детей с ЛДЖ до и после ферротерапии представлена в табл. 2.
В ходе исследования нами не выявлено каких–либо нежелательных реакций. Только у 12% детей, имеющих функциональные нарушения со стороны желудочно–кишечного тракта, отмечалась склонность к запорам на фоне лечения препаратом Феррум Лек. Курс лечения завершил 41 ребенок из 43 детей, таким образом, приверженность к лечению составила 95,3%. В 100% случаях дети принимали препарат Феррум Лек в форме сиропа с удовольствием.
Лечение препаратом Феррум Лек в течение 8–12 недель привело к нормализации показателей гемограммы, уровня гемоглобина, улучшению показателей обеспеченности железом у всех обследованных детей c ЖДА. Общая длительность ферротерапии в этой группе пациентов составила 12–20 недель. Продолжительность лечения при ЛДЖ составила 4–8 недель.
Отсутствие осложнений и нежелательных явлений свидетельствует о безопасности применения препарата Феррум Лек.
Важным преимуществом препарата Феррум Лек является не только его высокая эффективность, но и хорошая переносимость, а также удобная форма выпуска в виде сиропа, хорошие органолептические качества, что позволяет считать Феррум Лек оптимальным препаратом для лечения и профилактики ЖДА у детей раннего возраста.
1. Анемии у детей: диагностика и лечение /Практическое пособие для врачей под редакцией Румянцева А.Г., Токарева Ю.Н.. – М.: МАКС Пресс, 2000 – 9–17 с.
2. Белошевский В.А. Железодефицит. – Воронеж, 2000.
3. Бисярина В.П., Казакова Л.М. Железодефицитные анемии у детей раннего возраста. – М.:Медицина, 1976. – 176 с.
4. Воробьев П.А. Анемический синдром в клинической практике. М. – 2001, с. 36–94.
5. Дворецкий Л.И. Железодефицитные анемии. – М., 1998.
6. Идельсон Л.И. Гипохромные анемии. – М.:Медицина, 1981. – 192 с.
7. Коровина Н.А., Заплатников А.Л., Захарова И.Н. Железодефицитные анемии у детей. – М., 1999.
8. Казюкова Т.В., Самсыгина Г.А., Калашникова Г.В., Румянцев А.Г., Фаллух А., Мотина А.г., Левина А.А. Новые возможности ферротерапии железодефицитной анемии. /Клиническая фармакология и терапия/М., 2000, том 9, №2, с.88–91.
9. Соболева М.К. Железодефицитная анемия у детей раннего возраста и кормящих матерей и ее лечение и профилактика Мальтофером и Мальтофером–Фол. /Педиатрия/, М., №6, 2001, 27–32.